
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是
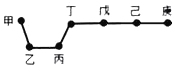
A.简单气态氢化物的稳定性:庚>己>戊>丁
B.单质甲与单质乙充分反应一定都可以生成多种化合物
C.可以通过分别电解熔融的金属氯化物的方法冶炼乙和丙的单质
D.因为庚元素的非金属性最强,所以庚的最高价氧化物对应水化物酸性最强
科目:高中化学 来源: 题型:
【题目】下图是自来水表的常见安装方式。下列有关说法不正确的是( )
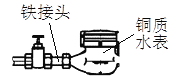
A. 发生腐蚀过程中,电子从接头流向水表
B. 腐蚀时,铁接头发生的是还原反应
C. 腐蚀时铜质水表发生的电极反应为:2H2O+O2+4e—=4OH—
D. 腐蚀过程还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能将成为21世纪的主要能源。太阳能光伏电池电解水可制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
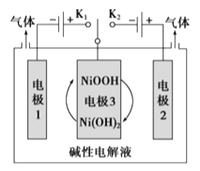
(1)制H2时,连接________(填“K1”或“K2”),产生H2的电极反应式是____________,溶液pH___________(填“增大”、“减小”或“不变”)。
(2)改变开关连接方式,可得O2,此时电极3的反应式为:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)开始2 min后,B的浓度减少0.6 mol·L1。下列说法正确的是
2C(g)+D(g)开始2 min后,B的浓度减少0.6 mol·L1。下列说法正确的是
A.用A表示的反应速率是0.8 mol·L1·s1
B.分别用B、C、D表示的反应速率,其比是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L1·min1
D.在这2 min内用B和C表示的反应速率数值相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.4kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(g) △H=-48.4kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) △H=-48.4kJ·mol-1
B.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-5517.6kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=-5517.6kJ·mol-1
C.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=+5517.6kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=+5517.6kJ·mol-1
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) △H=-48.4kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) △H=-48.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
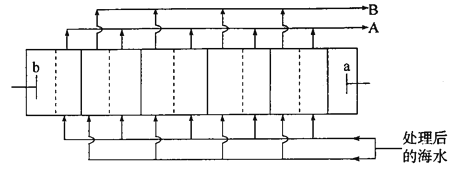
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。25℃时,向40ml浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是

A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) < c(CH3COOH)
C. c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-)
D. d点水的电离程度大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com