
【题目】(1)油脂属于_________类,其在碱性条件下的水解反应又称_________反应,产物为_________(写名称);
(2)在蔗糖和麦芽糖中,_________能发生银镜反应,二者_________同分异构体(填“属于”或“不属于”);蔗糖的水解反应式为_________;
(3)甲醛能使_________变性凝固,所以可用其稀溶液浸制生物标本;甲醛还是非常重要的合成原料,纯净的甲醛在一定条件下加聚生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_________;俄国化学家布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为________。
【答案】酯 皂化 高级脂肪酸盐和甘油 麦芽糖 属于 C12H22O11+H2O→C6H12O6(果糖)+C6H12O6(葡萄糖) 蛋白质 ![]() C6H12O6
C6H12O6
【解析】
(1)油脂是高级脂肪酸和甘油反应生成的酯,属于酯类;油脂在碱性条件下水解生成高级脂肪酸盐和甘油,高级脂肪酸盐是肥皂的主要成分,所以该反应被成为皂化反应,故答案为:酯,皂化,高级脂肪酸盐和甘油;
(2)蔗糖不含醛基,麦芽糖含有醛基,能发生银镜反应;二者结构不同,但是具有相同的分子式:C12H22O11,所以属于同分异构体;蔗糖的水解生成一分子葡糖糖和一分子果糖,方程式为:C12H22O11+H2O→C6H12O6(果糖)+C6H12O6(葡萄糖);故答案为:麦芽糖,属于,C12H22O11+H2O→C6H12O6(果糖)+C6H12O6(葡萄糖);
(3)甲醛能使蛋白质变性;甲醛含有双键可以发生加聚反应,生成聚甲醛,结构简式为 ![]() ;6个甲醛分子加合得到己糖,甲醛的分子式为:CH2O,依据原子个数守恒可知此己糖的分子式为C6H12O6 ,故答案为:蛋白质,
;6个甲醛分子加合得到己糖,甲醛的分子式为:CH2O,依据原子个数守恒可知此己糖的分子式为C6H12O6 ,故答案为:蛋白质,![]() ,C6H12O6。
,C6H12O6。


科目:高中化学 来源: 题型:
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是

A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_____________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是
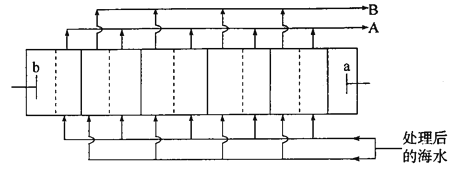
A. 工作过程中b极电势高于a极
B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜
C. 海水预处理主要是除去Ca2+、Mg2+等
D. A口流出的是“浓水”,B口流出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
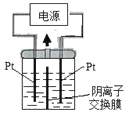
已知:3I2+6OH—=IO3—+5I—+3H2O
下列说法不正确的是
A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH—
B. 电解结束时,右侧溶液中含有IO3—
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
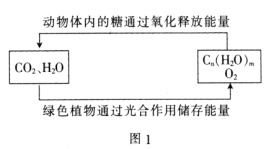
【题目】“低碳经济”备受关注,CO2的捕集、利用与封存成为科学家研究的重要课题。
(1)绿色植物通过图1所示过程储存能量,用化学方程式表示其光合作用的过程:_______。
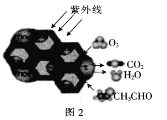
(2)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。图2为在TiO2的催化,O3降解CH3CHO的过程,则该反应的化学方程式为_____________________。
(3)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=-802 kJ/mol
CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ/mol
O2(g)=CO2(g) △H2=-283 kJ/mol
CO(g)+H2O(g)=CO2(g)+2H2(g) △H3=-41 kJ/mol
则反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的 △H=___________________________。
2CO(g)+2H2(g)的 △H=___________________________。
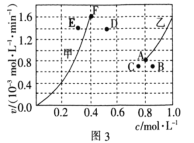
②为了探究反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol/L,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图3):v正-c(CH4)和v逆-c(CO),则与v正-c(CH4)相对应的是图中曲线________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(4)用稀氨水喷雾捕集CO2最终可得产品NH4HCO3。
①在捕集时,气相中有中间体NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
2NH3(g)+CO2(g)。实验测得的有关数据见下表(t1<t2<t3)。
| 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
氨基甲酸铵分解反应是_______(填“放热”或“吸热”反应)。15℃时,此反应的化学平衡常数K=____________________。
②在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____________________(已知常温下NH3·H2O的电离平衡常Kb=2×10-5,H2CO3的电离平衡常Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.室温下,0.01 mol/ L的盐酸溶液的pH是____,0.05 mol/ L的Ba(OH)2溶液的pH是___,pH=3的盐酸稀释100倍,所得溶液pH是____,pH = 9的NaOH溶液稀释1000倍后溶液中c(OH)与c(Na+)之比是___。
Ⅱ.水的电离平衡曲线如下图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从____增加到____。
(2)100℃的温度下将pH=8的KOH溶液与pH=5的稀H2SO4混合,并保持100℃的恒温,欲使混合溶液pH=7,则KOH溶液与稀H2SO4的体积比是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com