
【题目】图中甲池的总反应式为![]() 。
。
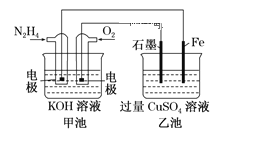
(1)甲池中负极上的电极反应式为_____________________。
(2)乙池中石墨电极上电极反应式为_________________________________。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 _______________。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为_________________g。
【答案】N2H4+4OH--4e-=N2↑+4H2O 2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑ A、C 12.8
【解析】
从图中可以看出,甲池为燃料电池,乙池为电解池。通N2H4的电极为负极,通O2的电极为正极;乙池中,石墨电极为阳极,铁电极为阴极。
(1)甲池中通入N2H4的电极为负极,N2H4在碱性条件下失电子,生成N2等。
(2)乙池中石墨电极为阳极,H2O失电子,生成O2等。
(3)要使乙池恢复到电解前的状态,应先看阴、阳极的产物,离开溶液的两电极产物反应后,加入电解后的乙池电解质溶液中,即可恢复原来的性质。
(4)乙池电极得失电子的物质的量,与N2H4失电子的物质的量相等,当甲中消耗1.6gN2H4时,线路中通过的电子为![]() =0.2mol,即可求出乙池中两个电极质量差。
=0.2mol,即可求出乙池中两个电极质量差。
(1)甲池中通入N2H4的电极为负极,N2H4在碱性条件下失电子,生成N2等,电极反应式为N2H4+4OH--4e-=N2↑+4H2O。答案为:N2H4+4OH--4e-=N2↑+4H2O;
(2)乙池中石墨电极为阳极,H2O失电子,生成O2等,电极反应式为2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑。答案为:2H2O-4e-=O2↑+4H+或4OH--4e-=2H2O+O2↑;
(3)乙池中石墨电极反应式为2H2O-4e-=O2↑+4H+,铁电极反应式为Cu2++2e-=Cu,O2与Cu反应生成CuO,所以应往溶液中加入CuO或CuOCO2。答案为:A、C;
(4)在乙池中,石墨电极换为铜电极,电极反应式为Cu-2e-=Cu2+,铁电极不变,铁电极发生的反应式为Cu2++2e-=Cu。当甲中消耗1.6gN2H4时,线路中通过的电子为![]() =0.2mol,即可求出乙池中,铜电极质量减轻0.1mol×64g/mol=6.4g,Fe电极质量增重0.1mol×64g/mol=6.4g,两个电极质量差为6.4g-(-6.4g)=12.8g。答案为:12.8。
=0.2mol,即可求出乙池中,铜电极质量减轻0.1mol×64g/mol=6.4g,Fe电极质量增重0.1mol×64g/mol=6.4g,两个电极质量差为6.4g-(-6.4g)=12.8g。答案为:12.8。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )
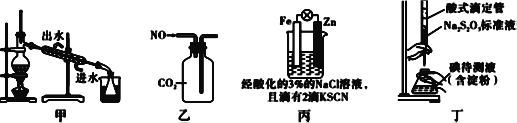
A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
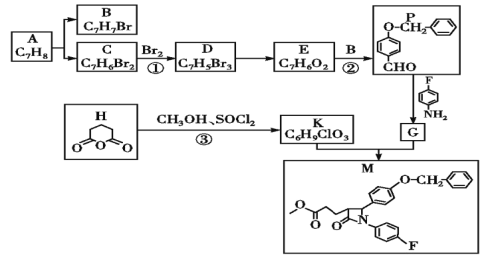
【题目】依折麦布(Ezetimibe)是一种高效的的胆固醇吸收抑制剂,合成它的一种重要中间体M的结构如图所示。某兴趣小组以甲苯和戊二酸酐为原料,设计了以下合成路线,部分条件和产物已略去。
已知:Ⅰ.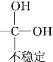
![]()
![]()
Ⅱ.![]() +RNH2
+RNH2
Ⅲ. (R1为H或烃基)
(R1为H或烃基)
请回答:
(1)物质A的结构简式为______。
(2)下列说法正确的是______。
A.由甲苯制B需用Fe作催化剂
B.物质H水解后产物的最简单同系物为乙二酸
C.反应①②③均为取代反应
D.1mol物质C最多能与2molNaOH反应
(3)写出反应②的化学方程式:_____。
(4)写出同时符合下列条件的比![]() 多2个碳的同系物N的所有同分异构体的结构简式:______。
多2个碳的同系物N的所有同分异构体的结构简式:______。
①属芳香族化合物②能与酸反应③1H—NMR谱中出现3个峰
(5)设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮(![]() )的合成路线:_____(用流程图表示,无机试剂任选)。
)的合成路线:_____(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α—松油醇是生产香精的重要原料,合成路线如图所示:
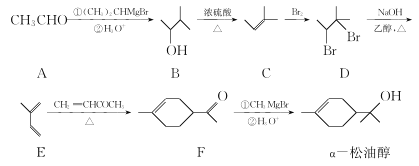
(1)α—松油醇中所含官能团的名称为______________。
(2)C→D的反应类型为______________ 。
(3)E→F的反应中有副产物X(与F互为同分异构体)生成,写出X的结构简式:______________。
(4)α—松油醇的一种同分异构体同时满足下列条件.写出该同分异构体的结构简式:______________。
①分子中所有化学键均饱和;
②分子中不同化学环境的氢原子数目比为1:4:4。
(5)已知:RBr![]() RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备
RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是
①CH2O、C2H4O2、C6H1206
②H2、CO、CH3OH
③CH2=CH2、C2H5OH、HOCH2CH2COOH
④C6H6、 C5H10、C7H6O2
A.③④B.①②C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
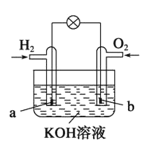
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯——水合肼法”制备叠氮化钠的生产流程如下:
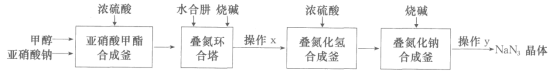
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:___。
(2)叠氮环合塔中生成叠氮化钠的反应方程式为___。
(3)水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为___;叠氮环合塔中滴加的烧碱溶液要适当过量,目的是__ ;生产流程中操作x为加热、浓缩,此时所得浓缩液的溶质中含钠的化合物有Na2SO4和___。
(4)该生产过程中可循环使用的物质是___。
(5)生产中有HN3生成,请设计实验证明HN3为弱酸:___。
(6)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5mol·L-1的NaClO溶液___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Al3+、Cu2+、SO42-、Cl-
B.中性溶液中:Al3+、NH4+、Cl-、S2-
C.c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
D.在由水电离出的c(H+)=10-13mol·L-1的溶液中:NH4+、AlO2-、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com