
【题目】高炉炼铁过程中发生的主要反应为
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH____(填“>”“<”或“=”)0。
(2)在一个容积为10 L的密闭容器中,1 000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=____、CO的平衡转化率=____。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
【答案】K=![]() < 0.006 mol·(L·min)-1 60% C
< 0.006 mol·(L·min)-1 60% C
【解析】
(1)平衡常数表达式中不能用固体或纯液体表示,故K=![]() ;由表中数据可知,随着温度升高,平衡常数减小,表明平衡向逆反应方向移动,即正反应为放热反应,故ΔH<0。
;由表中数据可知,随着温度升高,平衡常数减小,表明平衡向逆反应方向移动,即正反应为放热反应,故ΔH<0。
(2)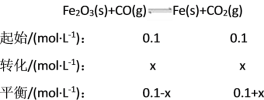
K==4.0,x=0.06,v(CO2)==0.006 mol·(L·min)-1,CO转化率=![]() ×100%=60%。
×100%=60%。
(3)A、B项中,增加或减少固体的量不会影响化学平衡移动,故不可以;
C项,移出部分CO2,可以增大CO转化率;
D项,提高反应温度,平衡向逆反应方向移动,CO转化率减小;
E项,减小容器的容积,即加压,平衡不移动,CO的转化率不变;
F项,催化剂不影响化学平衡移动,故不影响CO转化率。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3= 7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是:

A.电流从左侧A电极经过负载后流向右侧B电极
B.当有4.48 L NO2被处理时,转移电子数为0.8NA
C.电极A极反应式为2NH3-6e-= N2+6H+
D.为使电池持续放电,离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

(1) “焙烧”时,提高反应速率的措施有____________(写一条)。
(2)炉气中的有害气体成分是__________。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO2+2NH3![]() CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是
A.中子数为8的碳原子:![]() CB.NH3的电子式:
CB.NH3的电子式:![]()
C.氧原子的结构示意图:![]() D.CO(NH2)2的结构简式:
D.CO(NH2)2的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.由CH4、O2和KOH溶液组成的燃料电池,负极反应为CH4+8OH--8e-=CO2+6H2O
B.常温下,反应2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)能自发进行,该反应ΔH<0
C.反应C(s)+H2O(g)![]() CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
CO(g)+H2(g)达平衡后,缩小容器体积,H2O(g)平衡转化率不变
D.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
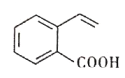
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的10种元素,完成下列各小题。

(1)表中元素,金属性最强的元素是_______,非金属性最强的元素是_______;(填元素名称)
(2)Ar原子结构示意图为__________;
(3)沼气的主要成分是_____________(填化学式);
(4)在第3周期元素中,最高价氧化物对应水化物酸性最强的是__________(填化学式),最高价氧化物对应水化物碱性最强的是____________(填化学式),形成的气态氢化物中,最稳定的是____________(填化学式);
(5)C和N中,原子半径较小的是__________;
(6)“高钙牛奶”中的钙是指__________(填“元素”或“单质”);
(7)Si是带来人类文明的重要元素之一,其氧化物常用于制造__________ (填一种高性能的现代通讯材料的名称);
(8)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为__________;
(9)O元素形成的一种氢化物的化学式是__________ ,该物质中H元素与O元素的质量比为__________ 。(相对原子质量:H-1 ; O-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO3-的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
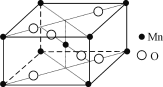
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有物质的量浓度均为![]() 的8种溶液:
的8种溶液:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)![]() 由小到大的顺序为______________________________________(填序号)。
由小到大的顺序为______________________________________(填序号)。
(2)取两种溶液等体积混合,充分反应后溶液呈中性,则这两种溶液是_________________(填溶质的化学式,下同)。
(3)若上述溶液的体积均为![]() ,加水稀释至
,加水稀释至![]() ,
,![]() 的溶液是____________________。若要使
的溶液是____________________。若要使![]() 溶液的
溶液的![]() ,则应该加入
,则应该加入![]() 溶液的体积为____________________。
溶液的体积为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com