
����Ŀ��Ϊ�˲ⶨij�л���A�Ľṹ��������ʵ�飺
�ٽ�2.3g���л�����ȫȼ�գ�����0.1mol CO2��2.7gˮ��
���������Dzⶨ����Է�������������ͼ(��)��ʾ������ͼ��
���ú˴Ź����Ǵ����û�����õ���ͼ(��)��ʾͼ�ף�ͼ������������֮����1��2��3��
�Իش��������⣺
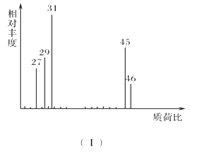
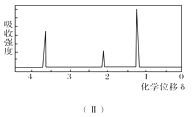
��1���л���A����Է���������________��
��2���л���A��ʵ��ʽ��________��
��3��A�ķ���ʽ��________��
��4���Ʋ��л���A�Ľṹ��ʽΪ____��A�к������ŵ�������_____��
���𰸡�46 C2H6O C2H6O CH3CH2OH �ǻ�
��������
��1�������ʺɱȿ�֪�����л���A����Է�����Ϊ46��
��2������2.3g���л�����ȼ�����ɵĶ�����̼��ˮ�����ж��л���A�е�̼Ԫ�ء���Ԫ�ص����ʵ��������������ж��Ƿ�����Ԫ�أ������C��H��OԪ�ص����ʵ���֮�ȣ����ȷ��A��ʵ��ʽ��
��3����Ϊʵ��ʽ��C2H6O���л����У���ԭ�����Ѿ��ﵽ���ͣ�������ʵ��ʽ��Ϊ����ʽ��
��4����Ϻ˴Ź��������жϸ��л�����ӵĽṹ��ʽ��
��1����A������ͼ�У�����ʺɱ�Ϊ46����������Է�������Ҳ��46���ʴ�Ϊ��46��
��2��2.3g���л����У�n(C)=n(CO2)=0.1mol�����е�̼ԭ�ӵ�����Ϊm(C)=0.1mol��12g��mol-1=1.2g����ԭ�ӵ����ʵ���Ϊ��n(H)=![]() ��2=0.3mol����ԭ�ӵ�����Ϊm(H)=0.3mol��1g��mol-1=0.3g�����л�����m(O)=2.3g-1.2g-0.3g=0.8g����Ԫ�ص����ʵ���Ϊn(O)=
��2=0.3mol����ԭ�ӵ�����Ϊm(H)=0.3mol��1g��mol-1=0.3g�����л�����m(O)=2.3g-1.2g-0.3g=0.8g����Ԫ�ص����ʵ���Ϊn(O)=![]() =0.05mol����n(C)��n(H)��n(O)=0.1mol��0.3mol��0.05mol=2��6��1������A��ʵ��ʽ�ǣ�C2H6O���ʴ�Ϊ��C2H6O��
=0.05mol����n(C)��n(H)��n(O)=0.1mol��0.3mol��0.05mol=2��6��1������A��ʵ��ʽ�ǣ�C2H6O���ʴ�Ϊ��C2H6O��
��3����Ϊʵ��ʽ��C2H6O���л����У���ԭ�����Ѿ��ﵽ���ͣ�������ʵ��ʽ��Ϊ����ʽ���ʴ�Ϊ��C2H6O��
��4��A���������ֿ��ܵĽṹ��CH3OCH3��CH3CH2OH����Ϊǰ�ߣ����ں˴Ź���������Ӧֻ��1���壻��Ϊ���ߣ����ں˴Ź���������Ӧ��3���壬����3��������֮����1��2��3����ȻCH3CH2OH�������⣬����AΪ�Ҵ����ṹ��ʽΪCH3CH2OH���Ҵ��Ĺ�����Ϊ�ǻ����ʴ�Ϊ��CH3CH2OH���ǻ���


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=2������һԪ��x��y�������Ϊ100mL��ϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ���ֱ�μ�NaOH��Һ���ζ��յ㣬����NaOH��Һ�����ΪVx��Vy����

A.xΪ���ᣬVx<VyB.xΪǿ�ᣬVx>Vy
C.yΪ���ᣬVx<VyD.yΪǿ�ᣬVx>Vy
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��M��R���ֶ�����Ԫ�أ����ڱ���λ�����£�
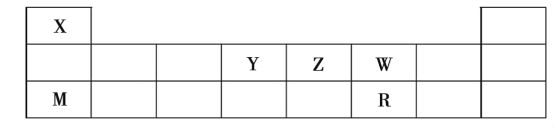
�Իش��������⣺
��1��X��Z��W��R����Ԫ�ص�ԭ�Ӱ뾶�ɴ�С������˳����______����Ԫ�ط��ű�ʾ����
��2����X��Z��W��R����Ԫ���е�����Ԫ�ؿ����һ��ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ����÷�Ӧ�Ļ�ѧ����ʽΪ_____________________________��
��3����X��W��M��R����Ԫ����ɵ�һ�����ӻ�����A����֪A���������ᷴӦ����������ˮ��Ӧ��д��A���������ᷴӦ�����ӷ���ʽ_________________________________��
��4������ʽΪX2Y2W4�Ļ������뺬�����ʵ�����KOH����Һ��Ӧ��������Һ�����ԣ���ԭ����____________________���÷���ʽ����Ҫ������˵������0.1mol��L��1����Һ�и�����Ũ���ɴ�С��˳��Ϊ________________________��
��5����X��Z��W��R��Fe����Ԫ�ؿ�������������Ļ�����T����Է�������Ϊ392����1molT�к���6mol�ᾧˮ���Ի�����T��������ʵ�飺
a.ȡT����Һ�����������NaOHŨ��Һ�����ȣ�������ɫ��������ɫ�д̼�����ζ�����塣��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��
b.��ȡT����Һ�����������BaCl2��Һ������ɫ������������������ܽ⡣
��T�Ļ�ѧʽΪ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�ϳɰ���ԭ����N2(g)��3H2(g)![]() 2NH3(g) ��H��-93.0kJ��mol-1
2NH3(g) ��H��-93.0kJ��mol-1
��1����֪һ�������£�2N2(g)��6H2O(l)![]() 4NH3(g)��3O2(g) ��H��+l 530.0kJ��molһ1��������ȼ���ȵ��Ȼ�ѧ����ʽΪ___��
4NH3(g)��3O2(g) ��H��+l 530.0kJ��molһ1��������ȼ���ȵ��Ȼ�ѧ����ʽΪ___��
��2����ͼ���ں��º���װ���н��кϳɰ���Ӧ��
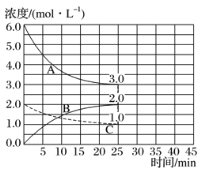
�ٱ�ʾN2Ũ�ȱ仯��������____��
��ǰ25min�ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������____��
����25minĩ�պ�ƽ�⣬��ƽ�ⳣ��K��____��
��3���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ����___��
A������������ٱ仯������ƽ��
B�������ܶȲ��ٱ仯����δƽ��
C��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ�
D��ƽ���ѹ�����������ɸ���NH3
��4���糧�����ѵ�������Ӧ�٣�4NH3(g)��6NO(l)![]() 5N2(g)��6H2O(g) ��H��0������Ӧ�ڣ�2NH3(g)��8NO(g)
5N2(g)��6H2O(g) ��H��0������Ӧ�ڣ�2NH3(g)��8NO(g)![]() 5N2O(g)��3H2O(g)��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ��
5N2O(g)��3H2O(g)��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ��

��ش���400��600Kʱ��ƽ��������N2�������¶ȵı仯������___���������ֹ��ɵ�ԭ����___(�δ������һ��ԭ��)��
��5��ֱ�ӹ���ʽȼ�ϵ������NaOH��ҺΪ�������Һ����ط�ӦΪ4NH3��g��+3O2��2N2+6H2O�����缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ʵĵ���ʽ
NH4Cl��__________Na2O2��________CO2��___________-OH��__________
��2��ij������Ԫ�غ�����Ļ�ѧʽΪHXO3,����̬�⻯��Ļ�ѧʽΪHX����XԪ�������ڱ��е�λ��Ϊ_______��
��3��ʯ�͵��ۺ����÷��������֣�����____��Ŀ������������͵IJ�����_____��Ҫ�ǵõ����顢��ϩ����ϩ�Ȼ���ԭ�ϣ�_______�Ǵ�ʯ���л�ñ����ױ��Ȼ���ԭ�ϡ�
��4����д�л������Լ�
C2H6(C2H4) __________
����������������Ҵ���_____
�Ҵ���ˮ��____________
�����壩________________
��5��������ʽ��д
�ٺ��������������ڣ�ʹ��ϡ�����ữ��˫��ˮ����I-�����ӷ���ʽΪ_______
�ں�ˮ������������SO2��ˮ��Һ���еķ�Ӧ���ӷ���ʽΪ__________
���Խ��ʯ����Ҫ�ɷ�TiO2��Ϊԭ�����������ѵIJ�����Ҫ�У�
a.�����£�����ʯ�뽹̿�Ļ������ͨ��Cl2���õ�TiCl4��һ�ֿ�ȼ������__________
b.��ϡ�����壨��벣���Χ�ͼ��������£���þ��TiCl4��Ӧ�ɵõ���_____
��6���л�����ʽ��д
���Ҵ�ȥ�������������ȩ�Ļ�ѧ����ʽ��_______
�ڶԱ����������Ҷ�����һ�������·������۷�Ӧ���ɵ��ڵĻ�ѧ����ʽ��___
�۱���������Ӧ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ҫ�Ե⻯����ʽ���ڡ���һ��ѧ����С���ú���Ϊԭ����ȡ�����ⵥ�ʣ����ǽ��������ճɻң���ˮ����һ��ʱ�䣨�õ⻯�����ܽ���ˮ�У����õ�����������Һ��Ȼ������ʵ��������ȡ���ʵ⣺

��1��ָ����ȡ��Ĺ������йص�ʵ��������ƣ�a__________��c__________��
��2������c��Ҫ��������__________�����õ��л��Լ�������CCl4������ѡ������__________;�����CCl4��Һ��ͨ��__________��ã�����©���Ͽ�������©���¿�������
��3���Ӻ�����л���Һ����ȡ��ͻ����л���ҺCCl4������Ҫ����__________���۲���ͼ��ʾʵ��װ�ã�ָ����������b__________����ȴˮ��__________���루��A��B������������__________������������ƣ�
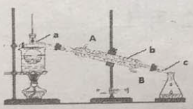
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�����Ȼ�����Һ�����ΪV mL���ܶ�Ϊ�� gmL��1����������Ϊw�����ʵ���Ũ��Ϊc molL��1����Һ������NaCl������Ϊm g������ѡ����ȷ����
A.���¶���NaCl���ܽ��S=![]() g
g
B.��Һ�����ʵ����ʵ���Ũ��c��NaCl��=![]() molL��1
molL��1
C.��Һ�����ʵ����ʵ���Ũ��c��NaCl��= ![]() molL��1
molL��1
D.��Һ�����ʵ���������w=![]() %
%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ѧ��Fulvio Cacace���˻���˼��������о������N4���ӡ�N4���ӽṹ����ͼ����֪����1mol N��N������942kJ����������1molN��N���ͷ�167kJ��������������Ϣ�����ݣ������Ȼ�ѧ����ʽ��ȷ����
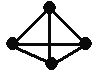
A. 2N2 = N4 ��H = ��882kJ��mol-1
B. N2 (g) = 0.5N4 (g) ��H = +441kJ
C. N2 (g) = 0.5N4 (g) ��H = ��441kJ��mol-1
D. 2N2(g) = N4(g) ��H = +882 kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com