
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:a__________,c__________。
(2)操作c需要的仪器是__________,所用的有机试剂可以是CCl4,简述选择理由__________;最后碘的CCl4溶液是通过__________获得(填“漏斗上口”或“漏斗下口”)。
(3)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过__________,观察下图所示实验装置,指出仪器名称b__________,冷却水从__________进入(填A或B),最后碘留在__________里。(填仪器名称)
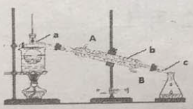
【答案】过滤 分液 分液漏斗,烧杯,铁架台 四氯化碳与水互不相容,碘单质易溶于四氯化碳 漏斗下口 蒸馏 冷凝管 B 蒸馏烧瓶
【解析】
(1)固体和液体分离,采用的操作是过滤,从碘水中获得碘单质,加入有机物,萃取分液,
故答案为过滤;分液。
(2)从碘水获得含有碘的有机物,需要分液操作,需要的仪器是分液漏斗,烧杯,铁架台,萃取选择萃取剂的原则是互不相容,溶质在两种溶剂中差别比较大,由于四氯化碳的密度大于水的密度,碘的四氯化碳在下层,从下端口放出,
故答案为分液漏斗,烧杯,铁架台;四氯化碳与水互不相容,碘单质易溶于四氯化碳;漏斗下口;
(3)从碘的四氯化碳溶液中获得碘单质,采用蒸馏的方法,蒸馏需要的仪器有冷凝管,冷却水从下口通入,蒸馏碘的沸点低于四氯化碳的沸点,故碘留在蒸馏烧瓶中,
故答案为蒸馏;直行冷凝管;B;蒸馏烧瓶。


科目:高中化学 来源: 题型:
【题目】实验室以MnO2、KClO3、CaCO3及盐酸等为原料制取KMnO4的步骤如下:
Ⅰ.MnO2的氧化![]()
Ⅱ.CO2的制取![]()
Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是____________________________;熔融时除了需要酒精灯、三脚架、坩埚钳、细铁棒及铁坩埚外,还需要的硅酸盐质仪器有___________________
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。
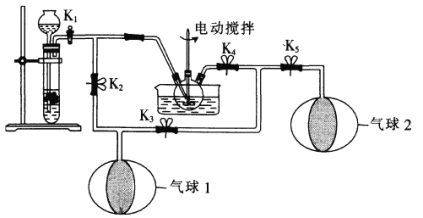
①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为______。
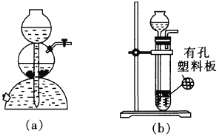
②为了充分利用CO2,实验开始时需关闭____________(填“K1”“K2”“K3”“K4”或“K5”,下同),其余均打开;待“气球1”中收集到足够多的CO2时,关闭______,其余均打开。
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
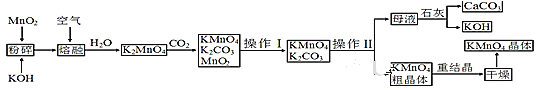
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列___物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)粉碎的目的是___;操作Ⅰ的名称是___;操作Ⅱ是根据KMnO4和K2CO3两物质在___(填性质)上差异,采用___(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、___和___(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是___。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水。
②用质谱仪测定其相对分子质量,得如图(Ⅰ)所示的质谱图。
③用核磁共振仪处理该化合物,得到如图(Ⅱ)所示图谱,图中三个峰的面积之比是1:2:3。
试回答下列问题:
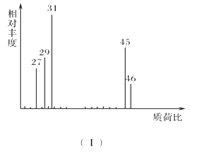
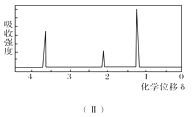
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是________。
(4)推测有机物A的结构简式为____,A中含官能团的名称是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,xg的甲气体和yg的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
A.甲与乙的相对分子质量之比等于x:y
B.等质量的甲与乙的分子个数之比等于x:y
C.同温同压下甲与乙的密度之比等于x:y
D.同温同体积下等质量的甲与乙的压强之比等于y:x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究1-溴丙烷是否发生消去反应,用下图装置进行实验,观察到酸性高锰酸钾溶液褪色。下列叙述不正确的是
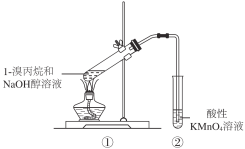
A. ②中一定发生了氧化还原反应
B. ①试管中也可能发生了取代反应
C. ①试管中一定发生了消去反应生成不饱和烃
D. 若②中试剂改为溴水,观察到溴水褪色,则①中一定发生了消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
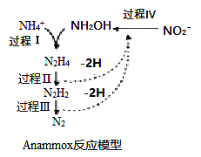
A. 1mol NH4+ 所含的质子总数为10NA
B. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
C. 该过程的总反应是:NH4+ + NO2- = N2↑ +2H2O
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com