
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
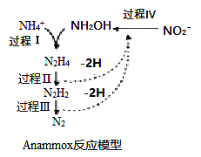
A. 1mol NH4+ 所含的质子总数为10NA
B. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
C. 该过程的总反应是:NH4+ + NO2- = N2↑ +2H2O
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
【答案】C
【解析】
A. 质子数等于原子序数,1mol NH4+ 所含的质子总数为11NA,故A错误;
B. 由图可知,1molNH4+经过过程I、II、III,(假设每步转化均完全)1molNH4+和1molNH2OH发生氧化还原反应生成1molN2,标准状况下的体积为22.4L,故B错误;
C. 由图可知,该过程的总反应是:NH4+ + NO2- = N2↑ +2H2O,故C正确;
D. 由图可知,1molNH4+经过过程I、II、III,(假设每步转化均完全)1molNH4+和1molNH2OH发生氧化还原反应生成1molN2,因此每处理1molNH4+,需要的NO2—为1mol,故D错误。


科目:高中化学 来源: 题型:
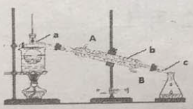
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:

(1)指出提取碘的过程中有关的实验操作名称:a__________,c__________。
(2)操作c需要的仪器是__________,所用的有机试剂可以是CCl4,简述选择理由__________;最后碘的CCl4溶液是通过__________获得(填“漏斗上口”或“漏斗下口”)。
(3)从含碘的有机溶液中提取碘和回收有机溶液CCl4,还需要经过__________,观察下图所示实验装置,指出仪器名称b__________,冷却水从__________进入(填A或B),最后碘留在__________里。(填仪器名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X与Y位于不同周期,X与W位于同一主族;原子最外层电子数之比N(Y):N(Q)=3:4;Z的原子序数等于Y、W、Q三种元素原子的最外层电子数之和。请回答下列问题:
(1)Y元素在周期表中的位置是______________;QX4的电子式为_____________。
(2)一种名为“PowerTrekk”的新型充电器是以化合物W2Q和X2Z为原料设计的,这两种化合物相遇会反应生成W2QZ3和气体X2,利用气体X2组成原电池提供能量。
①写出W2Q和X2Z反应的化学方程式:______________。
②以稀硫酸为电解质溶液,向两极分别通入气体X2和Z2可形成原电池,其中通入气体X2的一极是_______(填“正极”或“负极”)。
③若外电路有3mol电子转移,则理论上需要W2Q的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图,已知断裂1mol N≡N键吸收942kJ热量,生成1molN-N键释放167kJ热量根据以上信息和数据,下列热化学方程式正确的是
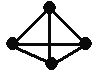
A. 2N2 = N4 △H = -882kJ·mol-1
B. N2 (g) = 0.5N4 (g) △H = +441kJ
C. N2 (g) = 0.5N4 (g) △H = -441kJ·mol-1
D. 2N2(g) = N4(g) △H = +882 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟“侯氏制碱法”原理,以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
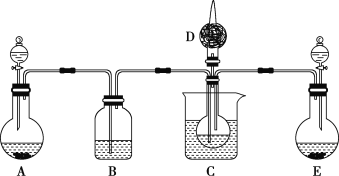
①E中制备气体时,所需药品是___(填字母)。
a.石灰石 b.生石灰 c.稀盐酸 d.浓氨水
②B中应盛有___溶液。在实验过程中,应向C中先通入足量的__。
③E装置向C中通气的导管不能插入液面下的原因是___。
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为4g。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
![]()
![]()
![]()
![]()
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,___。
②操作Ⅲ涉及的步骤名称为___、___、干燥。
③所得晶体中碳酸氢钠的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)加热装置Ⅰ时发生反应的化学方程式为___________________________。
(5)下列对于过氧化钠的叙述中,正确的是___________。
A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝
C.过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
D.过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是( )
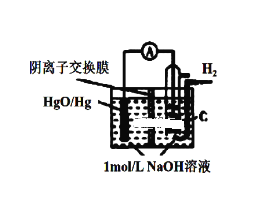
A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.OH-通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
C.每反应2.24L氢气,交换膜通过0.2mol离子
D.放电结束后,溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3 mol A和2.5 mol B混合于2 L密闭容器中,发生的反应如下:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
xC(g)+2D(g),5 min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1 mol/(L·min),下列结论正确的是
A. A的平均反应速率为 0.1 mol/(L·min)
B. 平衡时,C的浓度为 0.125 mol/L
C. 平衡时,B的转化率为 20%
D. 平衡时,容器内压强为原来的 0.8 倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com