
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是( )
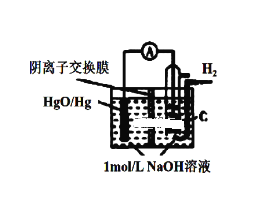
A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.OH-通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
C.每反应2.24L氢气,交换膜通过0.2mol离子
D.放电结束后,溶液的碱性减弱
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
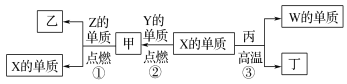
A.反应③可用于工业上制取W的单质B.X位于元素周期表第二周期ⅣA族
C.甲、丙、丁均为酸性化合物D.工业上通过电解乙来制取Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
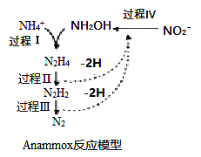
A. 1mol NH4+ 所含的质子总数为10NA
B. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
C. 该过程的总反应是:NH4+ + NO2- = N2↑ +2H2O
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)B单质与水反应的离子方程式 ______________________;
(3)下列表述中能证明元素D的非金属性比A强这一事实的是 _____________(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.一定条件下D和A的单质都能与钠反应
c.A最高价含氧酸的酸性弱于D最高价含氧酸
d.D单质能与A的氢化物反应生成A单质
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _________,试写出Y与H2O2溶液反应的离子方程式: __________________
②若Z是红棕色气体,则Z→W的反应中还原剂与氧化剂物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
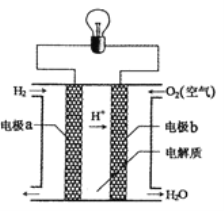
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 molB.3.2 molC.2.8 molD.1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com