
【题目】实验室模拟“侯氏制碱法”原理,以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
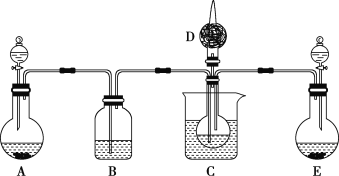
①E中制备气体时,所需药品是___(填字母)。
a.石灰石 b.生石灰 c.稀盐酸 d.浓氨水
②B中应盛有___溶液。在实验过程中,应向C中先通入足量的__。
③E装置向C中通气的导管不能插入液面下的原因是___。
(2)该小组同学为了测定C中所得碳酸氢钠晶体的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为4g。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:
![]()
![]()
![]()
![]()
![]()
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,___。
②操作Ⅲ涉及的步骤名称为___、___、干燥。
③所得晶体中碳酸氢钠的纯度为____%。
【答案】bd 饱和碳酸氢钠 氨气(或NH3) NH3极易溶于水 振荡、静置,向溶液中继续加入少量氯化钙溶液 过滤 洗涤 96.6
【解析】
(1)E中气体通入C中时,导管口没有深入液体中,A中生成的气体通入C中时,导管口深入液体中,说明A中制取的是二氧化碳、E中制取的是氨气;B装置的作用是除去二氧化碳中的氯化氢;
(2)碳酸氢钠加热分解为碳酸钠,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,根据碳酸钙沉淀的质量可计算碳酸氢钠的质量。
(1)根据以上分析,①E中制备氨气,装置没有加热,浓氨水和生石灰混合能放出氨气,所以需要药品是生石灰、浓氨水,选bd。
②B装置的作用是除去二氧化碳中的氯化氢,B中应盛有饱和碳酸氢钠溶液。氨气在水中的溶解度大于二氧化碳,所以在实验过程中,应向C中先通入足量的氨气。
③氨气极易溶于水,易引起倒吸,E装置向C中通气的导管不能插入液面下的原因是氨气极易溶于水,防倒吸。
(2)①若氯化钙不过量,则溶液中含有碳酸根离子,再加入氯化钙溶液会继续生成碳酸钙沉淀,为了判断加入氯化钙溶液是否过量,正确的实验操作是:在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液,若没有沉淀生成,则氯化钙过量。
②操作Ⅲ为从固液混合物中分离出固体,步骤名称依次为过滤、洗涤、干燥。
③碳酸氢钠加热分解为碳酸钠,反应方程式是2NaHCO3![]() Na2CO3+CO2↑+H2O,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,反应方程式是Na2CO3+CaCl2=CaCO3+2NaCl,反应总关系式是2NaHCO3——CaCO3,
Na2CO3+CO2↑+H2O,碳酸钠能与氯化钙溶液反应生成碳酸钙沉淀,反应方程式是Na2CO3+CaCl2=CaCO3+2NaCl,反应总关系式是2NaHCO3——CaCO3,
设碳酸氢钠的质量为xg
2NaHCO3——CaCO3
168 100
x 2.3
![]() x=3.864g
x=3.864g
晶体中碳酸氢钠的纯度为![]() ×100%=96.6%。
×100%=96.6%。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA表示阿伏加德罗常数,则下列说法中正确的是
①该硫原子的相对原子质量为12a/b ②m g该硫原子的物质的量为m/aNA mol
③12C原子的摩尔质量是12g或bNA g ④a g该硫原子所含的电子数为16
A.①③④B.②③④C.①②④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是( )
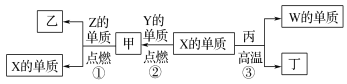
A.反应③可用于工业上制取W的单质B.X位于元素周期表第二周期ⅣA族
C.甲、丙、丁均为酸性化合物D.工业上通过电解乙来制取Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共 0.8mol, 这些气体恰好能被 600mL 2 mol·L—1NaOH 溶液完全吸收,生成含 NaNO3 和NaNO2 的盐溶液,其中 NaNO3 的物质的量为( )
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
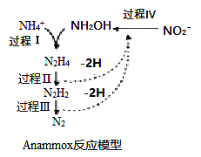
A. 1mol NH4+ 所含的质子总数为10NA
B. 1molNH4+经过过程I、II、III,(假设每步转化均完全)得到氮气的体积约为11.2L
C. 该过程的总反应是:NH4+ + NO2- = N2↑ +2H2O
D. 该方法每处理1molNH4+,需要的NO2—为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
A | 有3个电子层,K、M层电子数之和等于L层电子数 |
B | 短周期中金属性最强 |
C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
D | 元素最高正价是+7价 |
用化学用语回答下列问题:
(1)A元素在周期表中的位置 __________________;
(2)B单质与水反应的离子方程式 ______________________;
(3)下列表述中能证明元素D的非金属性比A强这一事实的是 _____________(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.一定条件下D和A的单质都能与钠反应
c.A最高价含氧酸的酸性弱于D最高价含氧酸
d.D单质能与A的氢化物反应生成A单质
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经图所示的过程转化为(其他条件略去)。![]()
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,无现象,然后滴加适量H2O2溶液,有白色沉淀生成,则该白色沉淀为 _________,试写出Y与H2O2溶液反应的离子方程式: __________________
②若Z是红棕色气体,则Z→W的反应中还原剂与氧化剂物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)可作为新型汽车动力燃料,以下是甲醇在工业上的制备过程:

请回答下列问题:
(1)在一定条件下反应室Ⅰ中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
CO(g)+3H2(g)。将1molCH4和2molH2O通入反应室Ⅰ(设反应室容积为10L),10min末有0.1molCO生成,则10min内反应的平均速率ν(H2)=_____mol/(L·min)。
(2)在容积不变的条件下,不能说明反应室Ⅰ中的反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不在改变 b.容器内的压强保持不变
c.CH4的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)在容积为1L反应室Ⅱ中充入1molCO与2molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
CH3OH(g),当反应达平衡时,CO的转化率为80%,则平衡前后的压强之比为____(最简整数比)。
(4)氢氧燃料电池的反应原理示意图如图所示。
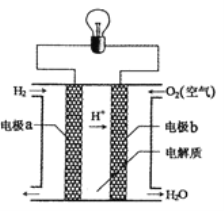
该电池中电极b是_____(填“正极”或“负极”),其电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
C.检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D.检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com