
【题目】将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共 0.8mol, 这些气体恰好能被 600mL 2 mol·L—1NaOH 溶液完全吸收,生成含 NaNO3 和NaNO2 的盐溶液,其中 NaNO3 的物质的量为( )
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
【答案】B
【解析】
51.2gCu的物质的量为0.8mol,整个过程发生的反应较复杂,但从氧化还原反应电子得失的角度分析可以简化为铜和氮间电子的转移,铜把硝酸还原成氮氧化合物,在NaOH溶液中氮氧化合物又转化成NaNO3和NaNO2,我们可以认为铜将失去的电子给了硝酸在氢氧化钠溶液中生成了NaNO2,根据得失电子数目相等得到n(Cu)=n(NaNO2),据此解答。
用终态分析法容易看出只有两种元素的价态有变化,其一是Cu→Cu(NO3)2,Cu元素化合价由0价升高为+2价,每个Cu原子失2个电子;另一个是HNO3→NaNO2,N元素由+5价降低为+3价,每个N原子得2个电子,51.2gCu的物质的量为:n(Cu)=![]() ,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为0.8mol;根据钠元素守恒n(NaNO3)= n(NaOH)- 0.8mol= 0.6L
,共失电子为0.8mol×2=1.6mol,HNO3到NaNO2共得到电子1.6mol,根据得失电子数目相等得到2n(Cu)=2n(NaNO2),故产物中NaNO2的物质的量为0.8mol;根据钠元素守恒n(NaNO3)= n(NaOH)- 0.8mol= 0.6L![]() 2 mol·L—1- 0.8mol=0.4mol;故选B。
2 mol·L—1- 0.8mol=0.4mol;故选B。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,水只作氧化剂的是
A. NaH+H2O=NaOH+H2↑ B. Na2O+H2O=2NaOH
C. HCl+NaOH=NaCl+H2O D. 2F2+2H2O=4HF+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L密闭容器中,发生反应:X(g)+Y(g)![]() 2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
2Z(g),达到平衡时,各物质的平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c (Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应X(g)+Y(g)![]() 2Z(g),可判断该反应达到化学平衡状态的是_____
2Z(g),可判断该反应达到化学平衡状态的是_____
A.单位时间内生成n molX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_________。
(3)a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是
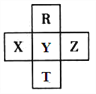
A. 原子半径 Z>Y>R
B. R与Y的电子数相差8
C. 非金属性:Z>Y>X
D. HZO4是目前无机酸中最强的含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
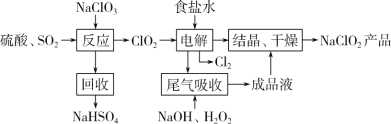
已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO23H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2 分解成NaClO3 和NaCl。
(1)写出“反应”步骤中的还原产物:__________。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:
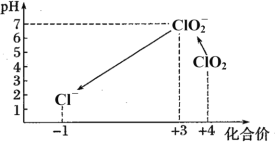
在步骤(3)过程中,溶液又呈蓝色,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要的有机高分子材料,结构简式为: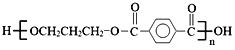 。合成M的一种途径如下:
。合成M的一种途径如下:
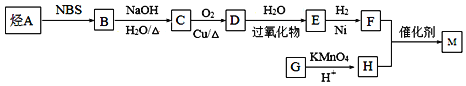
已知:①烃A在标准状况下的密度是1.875g·L-1;②CH3CH2CH=CH2![]() CH3CHBrCH=CH2;③R-CH=CH2+H2O
CH3CHBrCH=CH2;③R-CH=CH2+H2O![]() R-CH2CH2OH;④
R-CH2CH2OH;④![]() 。
。
回答下列问题:
(1)G的结构简式为___________;D中所含官能团的名称为____________________;
(2)A分子中最多有 __________个原子共平面;
(3)D→E反应类型为______________;
(4)写出下列反应的化学方程式:B→C:___________________________;F+H→M:_____________________________________________;
(5)满足以下条件的H的同分异构体有____________种。
①遇FeCl3溶液显紫色 ②可发生银镜反应 ③可与NaHCO3溶液生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若下列图像中横轴代表所加溶液体积,纵坐标代表生成沉淀质量,则各项描述中与图像能对应的是( )

A. 图①可能是MgCl2、AlCl3溶液逐滴加氨水至过量
B. 图②可能是AlCl3溶液逐滴加NaOH溶液至过量
C. 图③可能是NaAlO2溶液滴加稀盐酸至过量
D. 图④可能是含一定量HCl的AlCl3溶液逐滴加氨水至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )
A.3:2B.2:3C.1:1D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com