
【题目】亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
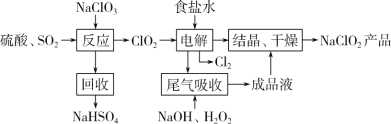
已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO23H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2 分解成NaClO3 和NaCl。
(1)写出“反应”步骤中的还原产物:__________。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:
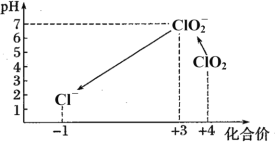
在步骤(3)过程中,溶液又呈蓝色,其原因是_________。
【答案】ClO2Na2CO3溶液、NaOH溶液2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2用 38℃—60℃的温水洗涤2ClO2+2KI=2KClO2+I20.135ClO2—在酸性环境中又将I—氧化为I2,淀粉遇I2变蓝色
【解析】
(1) “反应”步骤中硫酸、二氧化硫、NaClO3反应生成NaHSO4、ClO2,根据化合价变化分析还原产物;(2)粗盐精制时,用生成碳酸钙、氢氧化镁沉淀的方法除去Ca2+和 Mg2+;(3)根据流程图可知,“尾气吸收”是用氢氧化钠、H2O2吸收“电解”过程中排出的少量ClO2,生成NaClO2,根据得失电子守恒可知,产物中还有氧气;(4)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,用38-60℃的温水洗涤;(5)根据已知:ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中;向含有ClO2的水样中,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝,说明生成碘单质和KClO2。(6)根据2ClO2+2KI=2KClO2+I2、2Na2S2O3+I2=Na2S4O6+2NaI,找出关系式,2ClO2--I2--2S2O32-,根据关系式计算水样中ClO2的质量分数;(7)向(6)所得溶液中加硫酸调节水样pH至1~3,ClO2-表现氧化性,被还原为Cl-;
(1) “反应”步骤中硫酸、二氧化硫、NaClO3反应生成NaHSO4、ClO2,NaClO3中氯元素化合价降低生成ClO2,所以还原产物是ClO2;(2)粗盐精制时,用生成碳酸钙、氢氧化镁沉淀的方法除去Ca2+和 Mg2+,要加入的试剂分别为Na2CO3溶液、NaOH溶液;(3)根据流程图可知,“尾气吸收”是用氢氧化钠、H2O2吸收“电解”过程中排出的少量ClO2,生成NaClO2和氧气,反应离子方程式是2ClO2+H2O2+2OH-=2ClO2-+2H2O+O2;(4)根据以上分析,“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用 38℃—60℃的温水洗涤;④38℃~60℃干燥,得到产品。(5)向含有ClO2的水样中,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝,说明生成碘单质和KClO2,反应方程式是2ClO2+2KI=2KClO2+I2。
(6)设水样中ClO2的质量为x mg
2ClO2 -- I2 -- 2S2O32-,
135000mg 2mol
Xmg 5.00×10—5mol·L-1![]() 0.02L
0.02L
![]()
X=0.0675mg
水样中ClO2的质量分数![]() 0.135 mg·L-1 ;
0.135 mg·L-1 ;
(7)向(6)所得溶液中加硫酸调节水样pH至1~3,ClO2-在酸性环境中又将I-氧化为I2,淀粉遇I2变蓝色。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在某密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析不正确的是
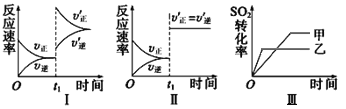
A.图Ⅰ研究的是t1时刻增大压强(缩小体积)对反应速率的影响
B.图Ⅱ研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
C.图Ⅱ研究的是t1时刻加入正催化剂对反应速率的影响
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
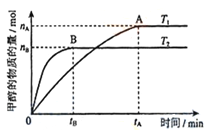
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当其他条件不变时,下列说法正确的是
A. 使用催化剂一定能加快反应速率
B. 用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率
C. 在N2+3H2![]() 2NH3反应中,增大N2浓度一定可以使H2全部转化为NH3
2NH3反应中,增大N2浓度一定可以使H2全部转化为NH3
D. 当反应物与生成物浓度相等时,可逆反应一定己达到化学反应限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共 0.8mol, 这些气体恰好能被 600mL 2 mol·L—1NaOH 溶液完全吸收,生成含 NaNO3 和NaNO2 的盐溶液,其中 NaNO3 的物质的量为( )
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素CO(NH2)2,原理如图。下列有关说法正确的是( )
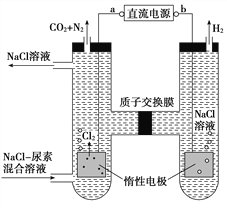
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44 L(标准状况),则除去的尿素为7.2 g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子。该小组同学取100 mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1 mol·L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:
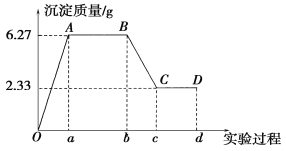
注明:Ob段表示滴加硝酸钡溶液;bd段表示滴加稀硝酸
(1)水样中一定含有的阴离子是________,其物质的量浓度之比为________。
(2)写出BC段所表示反应的离子方程式:__________________________________________。
(3)由B点到C点变化过程中消耗硝酸的体积为________。
(4)试根据实验结果推断K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是__________________。(若K+不存在,则不必回答该问)
(5)设计简单实验验证原水样中可能存在的离子:_____________________。(写出实验步骤、现象和结论)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是某药物的中间体,其结构简式如图所示。下列有关X的说法正确的是
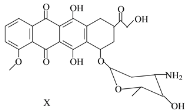
A. 每个X分子中含有5个手性碳原子
B. 一定条件下,X能与乙醇发生酯化反应
C. 一定条件下,X能发生消去反应
D. X既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
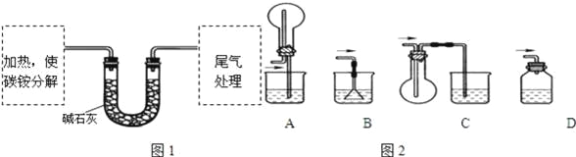
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com