
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
(定性实验)检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是_________和__________;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是________________;
(定量试验)测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.
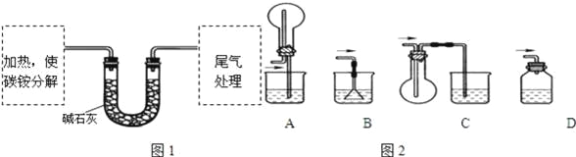
(3)碳铵固体应放在________中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2中的___________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_________g.
【答案】 HCO3﹣ CO32﹣ NH4++OH﹣=NH3↑+H2O、HCO3﹣+OH﹣=CO32﹣+H2O(或NH4++HCO3﹣+2OH﹣=NH3+CO32﹣+2H2O) A A ![]() (a﹣b)g
(a﹣b)g
【解析】【定性实验】取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,白色沉淀为碳酸钙;再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,则气体为氨气;据此回答(1)(2)。
【定量试验】ag碳铵,加热使之分解,碱石灰增重为水和二氧化碳的质量,尾气处理为氨气,
(3)因加热装置后连接U形管,以此选择仪器;
(4)尾气处理,应防止倒吸;
(5)灼烧后没有固体残余,称量U形管在实验前后的质量差为bg,则氨气的质量为(a-b)g;
详解: 【定性实验】取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成,白色沉淀为碳酸钙,盐中阴离子可能HCO3﹣、CO32﹣;再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色,则气体为氨气,则原固体中含铵根离子,
(1)由上述分析可以知道,阴离子可能为HCO3﹣、CO32﹣,因此,本题正确答案是:HCO3﹣、CO32﹣;
(2)碳铵与足量NaOH溶液加热反应的离子方程式可能是NH4++OH﹣=NH3↑+H2O、HCO3﹣+OH﹣=CO32﹣+H2O(或NH4++HCO3﹣+2OH﹣=NH3+CO32﹣+2H2O),
因此,本题正确答案是:NH4++OH﹣=NH3↑+H2O、HCO3﹣+OH﹣=CO32﹣+H2O(或NH4++HCO3﹣+2OH﹣=NH3+CO32﹣+2H2O);
【定量试验】ag碳铵,加热使之分解,碱石灰增重为水和二氧化碳的质量,尾气处理为氨气,
(3)因加热装置后连接U形管,则选择仪器只能为试管,
因此,本题正确答案是:A;
(4)尾气处理,应防止倒吸,B不能防止倒吸,C中气体收集时导管应短进,D中为密闭容器可能会炸裂,只有A装置收集及防倒吸,
因此,本题正确答案是:A;
(5)灼烧后没有固体残余,称量U形管在实验前后的质量差为bg,则氨气的质量为(a-b)g,则含N质量为![]() (a-b)g,
(a-b)g,
因此,本题正确答案是:![]() (a-b)g;
(a-b)g;


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
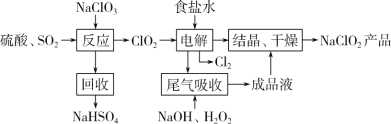
已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO23H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2 分解成NaClO3 和NaCl。
(1)写出“反应”步骤中的还原产物:__________。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2 产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:
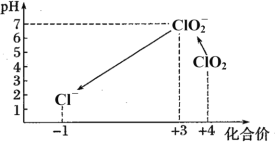
在步骤(3)过程中,溶液又呈蓝色,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ① 常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ② 通入CO2 | |
C. | Fe | FeCl2 | FeCl3 | ③ 加入Cu | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④ 加NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
Ⅰ. ①液氨、氨气 ②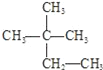 、
、 ![]() ③金刚石、C60 ④
③金刚石、C60 ④![]() 、
、![]()
上述四组物质中,互为同分异构体的是_____,互为同素异形体的是_____;属于同种物质的是___________(填序号)。
Ⅱ.现有以下五种物质:a.NH4Cl b.水晶 c.Na2O2 d.干冰 e.C60请用相应字母填空:
(1)属于分子晶体的是____________;
(2)属于共价化合物的是______________;
(3)熔化时只需要破坏共价键的是_____________;
(4)既含有离子键又含有共价键的是__________________;
(5)物质b与e相比,硬度较小的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )
A.3:2B.2:3C.1:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验
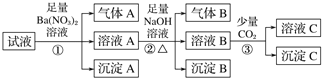
下列有关判断正确的是
A. 原溶液中一定有.Fe2+、Al3+、SO42-、NH4+、H+
B. 原溶液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中反应的离子方程式为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A、B之间肯定不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图。

(1)写出OA段离子反应方程式_______________。
(2)写出BC段离子反应方程式_______________。
(3)c[Al2(SO4)3]:c(AlCl3)=___________。
(4)整个过程中,得到沉淀的质量最大值是_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述不正确的是
A. 氧化镁(熔点2800℃)是优质的耐高温材料
B. 还原铁粉可用作食品袋内的抗氧化剂
C. 高炉炼铁过程中用石灰石与二氧化硅反应形成炉渣
D. 晶体硅是一种半导体材料,常用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cu、Ag都能溶解在硝酸中,某同学设计如下实验测量m g铜银合金样品中铜的质量分数,下列说法中正确的是( )
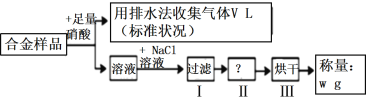
A. 被Cu还原的硝酸为![]() molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
molB. 操作I所用到的玻璃仪器是烧杯、蒸发皿、玻璃棒
C. 操作Ⅱ为蒸发D. 铜的质量分数为![]() ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com