
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。
(1)250 mL容量瓶、胶头滴管
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(答两点即可)
(3)2Cr3++3H2O2+H2O===Cr2O72—+8H+
(4)Na+、Mg2+、Ca2+ pH超过8会使部分Al(OH)3溶解生成AlO2—,最终影响Cr(Ⅲ)的回收与再利用
(5)Ca2+、Mg2+
(6)3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH
【解析】 (1)结合一定物质的量浓度的溶液的配制步骤即可写出缺少的玻璃仪器,注意容量瓶必须注明规格。(4)加入NaOH溶液调节pH=8,Fe3+、Al3+以Fe(OH)3、Al(OH)3形式沉淀下来,溶液中还有Mg2+、Ca2+及加入的Na+。(5)运用钠离子交换树脂的目的是除去滤液Ⅱ中的Mg2+、Ca2+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年高一下化学必修2 3-4-2糖类油脂蛋白质在生活中作用练习卷(解析版) 题型:选择题
某精细化工厂将棉花加工成很细的颗粒结构,然后把它添加到食品中去,可改变食品的口感,使食品易加工成型,降低人体获得的热量等,这是因为纤维素( )。
A.是人体的重要营养物质
B.在人体中水解成葡萄糖
C.不能被所有动物吸收
D.不能被人体吸收,但可促进消化
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十六 基本理论综合应用题练习卷(解析版) 题型:填空题
多晶硅是太阳能光伏产业的重要原材料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)=SiO(g)+CO(g) ΔH=a kJ·mol-1
2SiO(g)=Si(s)+SiO2(s) ΔH=b kJ·mol-1
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为________________________________。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:
SiHCl3(g)+H2(g) Si(s)+3HCl(g)。
Si(s)+3HCl(g)。
不同温度及不同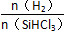 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。
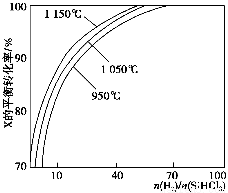
①X是________(填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1 150 ℃)________K(950 ℃)(填“>”、“<”或“=”)。
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
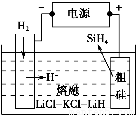
①用粗硅作原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式为_________________________________________。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十二 常见无机物的性质及其综合应用练习卷(解析版) 题型:选择题
某同学向一支空试管中按一定的顺序分别加入下列四种物质(一种物质只加一次):①KI溶液
②淀粉溶液 ③NaOH溶液 ④新制氯水。发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色。依据溶液颜色的变化判断加入以上物质的顺序是 ( )。
A.①→②→③→④ B.①→④→②→③
C.②→④→①→③ D.①→②→④→③
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十三 有机物结构及同分异构体数目判断练习卷(解析版) 题型:选择题
分子中含有4个甲基的C6H14,其一氯代物的同分异构体共有(不考虑立体异构) ( )。
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十一 元素的单质及其化合物的性质与转化练习卷(解析版) 题型:选择题
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )。

选项XYZ箭头上所标数字的反应条件
ACaOCa(OH)2CaCO3①常温遇水
BAlCl3NaAlO2Al(OH)3②通入CO2
CFe2O3FeCl3Fe(OH)3④加入盐酸
DCl2Ca(ClO)2HClO③加浓盐酸
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十 电解质溶液中微粒浓度的关系练习卷(解析版) 题型:选择题
25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。

A.当c(F-)>c(HF)时,溶液呈碱性
B.当pH=2时,c(F-)<c(K+)
C.25 ℃时,氢氟酸的电离平衡常数为4×10-6
D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练八 化学反应速率和化学平衡分析与判断练习卷(解析版) 题型:选择题
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )。
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )。

A.10 min时,改变的外界条件可能是升高温度
B.0~10 min内,v(H2)=0.15 mol·L-1·min-1
C.恒温下,缩小容器体积,一段时间内v(逆)>v(正)
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练一 化学与科学技术社会环境的关系练习卷(解析版) 题型:选择题
2013年4月22日是第44个“世界地球日”,其主题为“珍惜地球资源,转变发展方式”。下列做法符合这一主题的是( )。
①开发太阳能、风能和氢能等能源 ②大量开采地下水,以满足生产、生活的需求 ③在含硫的煤中加入适量生石灰 ④利用苯、甲苯等有机物代替水作溶剂 ⑤利用可降解的“玉米塑料”生产一次性饭盒
A.①②③ B.①③⑤ C.②④⑤ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com