
25 ℃时,x mol·L-1氢氟酸水溶液中,加入KOH固体调节溶液的pH(忽略加入固体引起的溶液体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是 ( )。

A.当c(F-)>c(HF)时,溶液呈碱性
B.当pH=2时,c(F-)<c(K+)
C.25 ℃时,氢氟酸的电离平衡常数为4×10-6
D.当pH=5时,c(HF)+c(K+)+c(H+)-c(OH-)=x mol·L-1
D
【解析】 A项,根据图像可以得出当c(F-)>c(HF)时,溶液也可以呈酸性;B项,由电荷守恒得,c(K+)+c(H+)=c(F-)+c(OH-),当pH=2时,c(H+)>c(OH-),则c(F-)>c(K+)时才满足电荷守恒;Ka=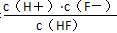 ,由图像可知两曲线交点时c(F-)=c(HF),pH约为3;即c(H+)=10-3 mol·L-1所以Ka=c(H+)=10-3,所以C项不正确;D项,根据电荷守恒,得c(K+)+c(H+)=c(F-)+
,由图像可知两曲线交点时c(F-)=c(HF),pH约为3;即c(H+)=10-3 mol·L-1所以Ka=c(H+)=10-3,所以C项不正确;D项,根据电荷守恒,得c(K+)+c(H+)=c(F-)+
c(OH-),若两边均加上c(HF),可得c(HF)+c(K+)+c(H+)=c(F-)+c(OH-)+c(HF),移项可得c(HF)+c(K+)+c(H+)-c(OH-)=c(F-)+c(HF),忽略加入固体引起的溶液体积变化,得c(F-)+c(HF)=x mol·L-1。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源:2014年江苏省南通市业水平测试(必修)化学试卷(解析版) 题型:选择题
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。下列反应可制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
下列判断正确的是
A.KClO3在反应中失去电子 B.H2C2O4是氧化剂
C.H2SO4发生氧化反应 D.生成2 mol ClO2时有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十五 常见仪器的使用及实验基本操作练习卷(解析版) 题型:选择题
下列实验操作中不正确的是 ( )。
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.NaCl溶液蒸发结晶时,当蒸发皿中有大量晶体析出时即可停止加热,利用余热蒸干
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十七 化学工艺流程题练习卷(解析版) 题型:填空题
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需_______________________ _。
(2)酸浸时,为了提高浸取率可采取的措施有_____________________________
______________________________________________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72—,写出此反应的离子方程式:_____________________________________________________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | - | - | - |
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72—转化为CrO42—。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十一 元素的单质及其化合物的性质与转化练习卷(解析版) 题型:选择题
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是 ( )。
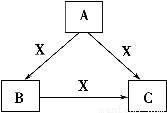
A.若X为Cl2,则C可为FeCl3
B.若X为KOH溶液,则A可为AlCl3
C.若X为O2,则A可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练十 电解质溶液中微粒浓度的关系练习卷(解析版) 题型:选择题
常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )。
A.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7,则该溶液的pH一定为14-a
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练六 盖斯定律应用与热化学方程式的书写练习卷(解析版) 题型:选择题
下列各组变化中,ΔH或Q前者小于后者的一组是( )。
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1
H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1
CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①②③ B.②④ C.②③④ D.③④
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练五 元素周期表中位-构-性关系的分析练习卷(解析版) 题型:选择题
短周期金属元素甲~戊在元素周期表中的相对位置如图所示。下列判断正确的是( )。
甲 | 乙 |
|
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
如图是某种含有C、H、O元素的有机物简易球棍模型。下列关于该有机物的说法正确的是( )

A.该物质属于酯类
B.分子式为C3H8O2
C.该物质在酸性条件下水解生成乙酸
D.该物质含有双键,能跟氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com