
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图。请回答下列问题:
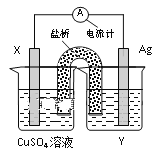
(1)电极X的材料名称是___;电解质溶液Y溶质的化学式是___;
(2)银电极为电池的___极,发生的电极反应为___;
(3)外电路中的电子是从___电极流向___电极。(填电极材料名称)。
(4)当有1.6g铜溶解时,银棒增重___g。
【答案】铜 AgNO3 正极 Ag++e-=Ag 铜 银 5.4
【解析】
(1)根据电池反应式知,Cu失电子发生氧化反应,作负极,Ag作正极,电解质溶液为含有银离子的可溶性银盐溶液;
(2)银电极上是溶液中的Ag+得到电子发生还原反应;
(3)外电路中的电子是从负极经导线流向正极;
(4)先计算Cu的物质的量,根据反应方程式计算出正极产生Ag的质量,即正极增加的质量。
(1)根据电池反应式知,Cu失电子发生氧化反应,Cu作负极,则Ag作正极,所以X为Cu,电解质溶液为AgNO3溶液,故答案为:铜;AgNO3;
(2)银电极为正极,正极上Ag+得到电子发生还原反应,正极的电极反应式为:Ag++e-=Ag,故答案为:正;Ag++e-=Ag;
(3)外电路中的电子是从负极Cu经导线流向正极Ag,故答案为:铜;银;
(4)反应消耗1.6 g铜的物质的量为n(Cu) =![]() =0.025 mol,根据反应方程式2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)可知:每反应消耗1 mol Cu,正极上产生2 mol Ag,则0.025 mol Cu反应,在正极上产生0.05 mol Ag,该Ag的质量为m(Ag)=0.05 mol×108 g/mol=5.4 g,即正极银棒增重5.4 g,故答案为:5.4。
=0.025 mol,根据反应方程式2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)可知:每反应消耗1 mol Cu,正极上产生2 mol Ag,则0.025 mol Cu反应,在正极上产生0.05 mol Ag,该Ag的质量为m(Ag)=0.05 mol×108 g/mol=5.4 g,即正极银棒增重5.4 g,故答案为:5.4。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从巴旦杏中提取有香味的有机物R,结构简式如图所示。下列有关R的说法错误的是
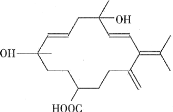
A.R既能与碳酸氢钠溶液反应,又能与钠粒反应
B.R能发生酯化、加成、氧化反应
C.R的羟基能在铜、加热条件下与O2反应生成醛基
D.R的分子式为C21H32O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)=C(g) △H,分两步进行:
①A(g)+B(g)=X(g) △H1 ②X(g)=C(g) △H2
反应过程中能量变化如图所示,E1表示A+B=X的活化能,下列说法正确的是( )
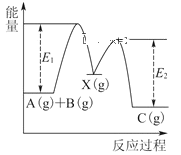
A.△H=E1-E2
B.X是反应A(g)+B(g)=C(g)的催化剂
C.E2是反应②的活化能
D.△Hl=△H-△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
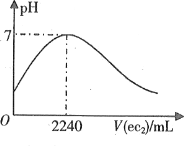
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
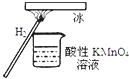
A. 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B. 水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______,Co2+核外3d能级上有_____对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________。1 mol配离子中所含σ键的数目为________,配位体N3-中心原子的杂化类型为________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________。
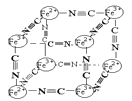
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________,立方体中Fe2+间连接起来形成的空间构型是________。K+空缺率(体心中没有K+的占总体心的百分比)为_____________。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________。
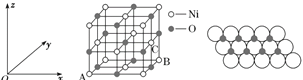
图甲 图乙
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,某小组在实验室中制备ClO2所用装置如图:[已知:SO2+2NaClO3+H2SO4=2ClO2+2NaHSO4]。
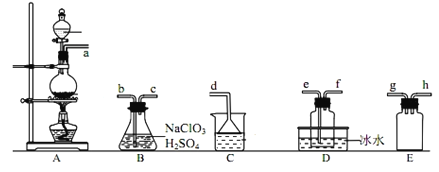
下列说法正确的是( )
A.装置C中装的是饱和食盐水,a流出气体为SO2
B.装置D放冰水的目的是液化二氧化硫防止污染环境
C.连接装置时,导管口a可接h或g,导管口c接e
D.可以选用装置A利用3mo/L盐酸与MnO2反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com