
【题目】298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )
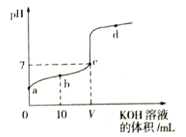
A. 水电离出的H+浓度:a<b<c<d
B. 氢氟酸的电离平衡常数:Ka=![]()
C. V=20
D. b点溶液中:c(F-)>c(HF)
【答案】D
【解析】
A.因为酸和碱都可抑制水的电离,氢氟酸与氢氧化钾反应生成的氟化钾水解可使溶液显碱性,促进了水的电离。由图像可知,a点只有氢氟酸、d点氢氧化钾过量较多,而c点接近滴定终点,故c点水的电离程度最大,A错误;B.由于c点pH=7,即c(H+)= c(OH-),由电荷守恒可知c( F- )= c(K+ )=V![]() 0. 01 mol/L /(20+V), c(F- ) +c(HF)=(20
0. 01 mol/L /(20+V), c(F- ) +c(HF)=(20![]() 10-3
10-3![]() 0.01mol/L)/ (20+V)
0.01mol/L)/ (20+V) ![]() 10-3=0.02/(20+V) mol/L,则 c(HF)= 0.02/(20+V)-0.01V/(20+V)=[(20-V)/ (20+V)]
10-3=0.02/(20+V) mol/L,则 c(HF)= 0.02/(20+V)-0.01V/(20+V)=[(20-V)/ (20+V)]![]() 0.01mol/L,所以氢氟酸的电离平衡常数:Ka= c( F- )
0.01mol/L,所以氢氟酸的电离平衡常数:Ka= c( F- ) ![]() c(H+)/ c(HF)= {10-7
c(H+)/ c(HF)= {10-7![]() [V
[V![]() 0. 01/(20+V)]}/ [(20-V)/ (20+V)]
0. 01/(20+V)]}/ [(20-V)/ (20+V)]![]() 0.01=V
0.01=V![]() 10-7/(20-V),故B错误。C. HF酸是弱酸,所以0. 01 mol/L的HF溶液中c(H+ )<0.01 mol/L。当加入氢氧化钾溶液的体积为20mL时,氢氟酸与氢氧化钾恰好反应生成的氟化钾水解可使溶液显碱性。c点pH=7,所以,加入的0.01mol·L-1 KOH溶液的体积小于20mL,即V<20,故C错误;D. b点表示等物质的量的HF和KF形成的混合溶液,溶液中存在电荷守恒:c(F-)+c(OH-)=c(K+ )+c(H+),物料守恒:c(F-)+c(HF)=2c(K+ ),两式联立消去钾离子项可得c(HF) +2c(H+ )=c(F-) +2c(OH-),以因为b点的pH<7, c(HF)< c(F-),故D正确;答案:D。
10-7/(20-V),故B错误。C. HF酸是弱酸,所以0. 01 mol/L的HF溶液中c(H+ )<0.01 mol/L。当加入氢氧化钾溶液的体积为20mL时,氢氟酸与氢氧化钾恰好反应生成的氟化钾水解可使溶液显碱性。c点pH=7,所以,加入的0.01mol·L-1 KOH溶液的体积小于20mL,即V<20,故C错误;D. b点表示等物质的量的HF和KF形成的混合溶液,溶液中存在电荷守恒:c(F-)+c(OH-)=c(K+ )+c(H+),物料守恒:c(F-)+c(HF)=2c(K+ ),两式联立消去钾离子项可得c(HF) +2c(H+ )=c(F-) +2c(OH-),以因为b点的pH<7, c(HF)< c(F-),故D正确;答案:D。


科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
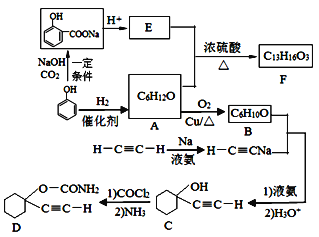
(1)A的化学名称是__________,C中含氧官能团的名称为__________。
(2)F的结构简式为______,A和E生成F的反应类型为______。
(3)A生成B的化学方程式为_______________。
(4) B与乙炔钠合成C的反应类型(酸化前)是_________;写出由C合成D的第二个反应的化学方程式_____________。
(5)同时满足下列条件的E的同分异构体有__________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ____________c(CH3COO-)(填“ >”或“=”或“<” )。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-)(填“>”“=”或“<”)。
(4)相同温度下等物质的量浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示:
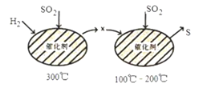
下列说法正确的是( )
A. SO2排放到空气中会形成pH≈5.6的酸雨
B. 可用CuSO4溶液检验是否有X气体生成
C. 在100℃~200℃温度时发生的是置换反应
D. 工业上可用浓硝酸处理工业尾气中的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:

已知部分物质的溶解度曲线如图1所示。
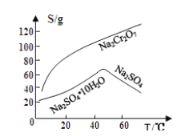
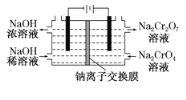
图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,在一定条件下发生下列反应:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是

A. 该反应的△H>0
B. NH3的体积分数不变时,该反应不一定达到平衡状态
C. 恒温恒容,A点时通入CO2,v(正)和v(逆)均增加
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知:SO2(g) +1/2O2(g)![]() SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
SO3(g) △H=-98 kJ·mol-1。某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) _____v(逆)(填“<”、“>”或“=”)。
(2)下表列出了常见的烟气脱硝的两种方法
编号 | 名称 | 原理 |
方法一 | 尿素法 | 在温度70—95℃时,尿素CO(NH2)2溶液吸收NO、NO2,将其转化为N2 |
方法二 | 选择性催化还原( SCR)法 | 以NH3等作为还原剂,将烟气中的NOx还原生成N2和H2O |
已知:N2(g)+O2(g)=2NO(g) △H=+180.6 kJ·mol—1
N2(g)+3H2(g)=2NH3(g) △H= -92.4kJ·mol—1
2H2(g)+O2(g)=2H2O(g)△H= -483.6 kJ·mol—1
则4NO(g) +4NH3(g)+O2(g)=4N2(g)+6H2O(g);△H=_________ kJ·mol-1。
(3)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) ![]() CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。

①该反应的ΔH_______0(选填“<”、“>”或“=”,下同),K1_________K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 14g乙烯中所含氢原子数为2NA
B. 6g14C原子中所含中子数为4NA
C. 标准状况下2.24LHC1气体中所含H+数为0.1NA
D. 0.1mol氯气溶于水制成饱和氯水,转移电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com