
【题目】重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工业流程如图所示:

已知部分物质的溶解度曲线如图1所示。
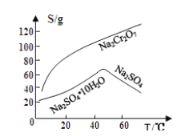
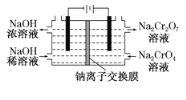
图1 图2
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为______________________________。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有_________(填化学式)。
(3)调节溶液的pH所选的试剂为__________________(填名称)。
(4)操作a的实验步骤为 _________________________。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式__________________________________。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式:___________________________________。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为____________。
(7)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1 以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________mol·L-1 ,废水处理后方能达到国家排放标准。
【答案】4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2 Na2SiO3、 NaAlO2 稀硫酸 发浓缩、冷却结晶、过滤 23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。 2H2O-4e-=O2
+ 3S2O32-+22OH-。 2H2O-4e-=O2![]() +4H+ (2-n)
+4H+ (2-n)![]() 100
100![]() ; 2.4×10-4
; 2.4×10-4
【解析】
根据铬铁矿的主要成分判断煅烧后的产物,根据杂质的成分及除杂产生的滤渣Al(OH)3和H2SiO3进行逆推,可知浸出液除了含有NaOH、Na2CO3、Na2CrO4外,还含有Na2SiO3, NaAlO2。根据电子守恒完成煅烧反应方程式;根据电池的正负极确定电解池的阴、阳极,根据氧化还原反应写电极反应方程式。
(1)铬铁矿主要成分Fe(CrO2)2,还含有Al2O3、Fe2O3、SiO2等杂质, 加入纯碱和空气高温煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+7O2+8Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2;答案:4Fe(CrO2)2+7O2+8 Na2CO3=2 Fe2O3+8 Na2CrO4+8CO2。
(2) 根据调节pH后产生滤渣Al(OH)3和H2SiO3.可知加入纯碱和空气高温煅烧后,再加水过滤,浸出液中除了含有NaOH、Na2CO3、Na2CrO4外应该还会有Na2SiO3、NaAlO2。答案:Na2SiO3、NaAlO2。
(3)根据酸化产物有Na2SO4可知调节溶液的pH所选的试剂为稀硫酸。答案:稀硫酸。
(4)由溶液通过操作a后混合物分离为液体a和固体a两部分,从液体a可以提取重铬酸钠晶体,则固体a为硫酸钠晶体,根据溶解度曲线可知,硫酸钠的溶解度在较高温度下较小,在较低温度下也较小,故可以蒸发浓缩得到硫酸钠的饱和溶液,再降温结晶析出硫酸钠晶体,所以操作a为蒸发浓缩、冷却结晶、过滤;答案:蒸发浓缩、冷却结晶、过滤。
(5)加入Na2S溶液反应后,硫元素全部以S2O32-的形式存在,CrO42生成Cr(OH)3,的离子方程式:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。答案:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3
+ 3S2O32-+22OH-。答案:23H2O+6S2-+ 8CrO42-= 8Cr(OH)3![]() + 3S2O32-+22OH-。
+ 3S2O32-+22OH-。
(6)①根据电池的正负极确定电解池b为阳极,电极反应方式为:2H2O-4e-=O2![]() +4H+;答案:2H2O-4e-=O2
+4H+;答案:2H2O-4e-=O2![]() +4H+;
+4H+;
②电解制备Na2Cr2O7过程的总反应方程式为Na2CrO+H2O = Na2Cr2O7+4NaOH+2H2![]() +O2
+O2![]() 设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x), (1-x)mol,生成的Na2Cr2O7为x/2mol,对应的n(Na)=xmol, n(Cr)= xmol,根据: Na与Cr的物质的量之比为n,计算得出x=2-d,转化率为(2-n)/1
设加入反应容器内的Na2CrO4为1mol,反应过程中有xmol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x)mol,对应的n(Na)=2(1-x), (1-x)mol,生成的Na2Cr2O7为x/2mol,对应的n(Na)=xmol, n(Cr)= xmol,根据: Na与Cr的物质的量之比为n,计算得出x=2-d,转化率为(2-n)/1![]() 100
100![]() =(2-n)
=(2-n)![]() 100
100![]() ;答案:(2-n)
;答案:(2-n)![]() 100
100![]() ;
;
(7)国家标准含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1,以下才能排放。 Ksp(BaCrO4)=,所以c(Ba2+)= Ksp(BaCrO4)/c(CrO42-)= 1.2×10-10/5.0×10-7=2.4×10-4;答案:2.4×10-4。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH===2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃

图1
请回答:
(1)仪器A的作用是___________________________________________;冰水浴冷却的目的是____________________________________(写出两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因______________________________________。
(3)Cl-存在时会催化ClO2生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:
①________________________________________________________________________
(用离子方程式表示),②H2O2+Cl2===2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过图2所示装置将少量30%H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是________,馏出物是________。

图2
(5)抽滤法分离NaClO2过程中,下列操作不正确的是________。
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
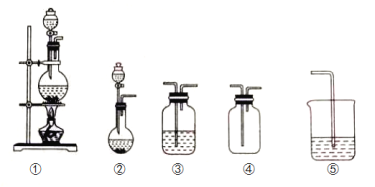
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③③ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )
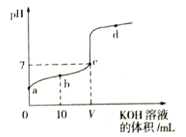
A. 水电离出的H+浓度:a<b<c<d
B. 氢氟酸的电离平衡常数:Ka=![]()
C. V=20
D. b点溶液中:c(F-)>c(HF)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2SO4溶液、K2CO3溶液、盐酸
(1)操作①的名称是___,操作②的名称是___。
(2)试剂a是___,固体B是___。(填化学式)
(3)生成沉淀A的离子反应方程式为:__加入试剂b所发生的化学反应方程式为:___。
(4)该方案能否达到实验目的:___。若不能,应如何改进(若能,此问不用回答)___。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是一种治疗缺血性脑卒药物,其合成路线如下:
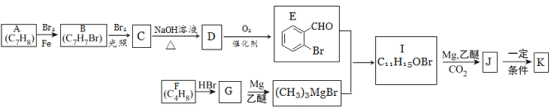
已知:ⅰ.有机物K是一种酯,分子中除苯环外还含有1个五元环;
ⅱ.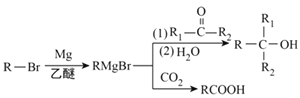 。
。
回答下列问题:
(1)有机物B的名称为____________,D的含氧官能团的名称是________________。
(2)C→D、F→G的反应类型分别为_________________、_________________。
(3)J的结构简式为______________,K的分子式为___________________。
(4)E与银铵溶液反应的化学方程式为____________________________。
(5)已知B在一定条件下可以水解生成X,与X互为同分异构体且含有苯环的有机物有_____种(不含X自身),写出其中核磁共振氢谱有4组吸收峰,且峰值比为3:2:2:1的结构简式__________________(任写一种)。
(6)利用题中信息所学知识,写出以甲烷和化合物A为原料,合成苯乙烯的路线流程图(其他试剂自选)__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示相同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中仅升高温度,纯水就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 图3 表示H2与O2反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com