
【题目】下表为元素周期表的一部分:
周期 族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图_________。
(2)②、③、⑤的离子半径由大到小的顺序为___________。
(3)元素④和⑥形成的化合物的电子式:_____________。
(4)元素②和⑤形成的化合物的化学式为____________。
科目:高中化学 来源: 题型:
【题目】有机物G(1,6-己二酸)是合成尼龙的主要原料之一,可由烃A制备,合成路线如图1,烃A的质谱图如图2,回答下列问题:


(1)A的化学名称为________,D的官能团名称为__________________。
(2)A→B的反应类型是______________,F→G的反应类型是_______________。
(3)F的结构简式为___________________________。
(4)若H2NRNH2为已二胺,则由G合成尼龙的反应方程式为_____________________________。与G含有相同官能团的同分异构体共有__________种,其中核磁共振氢谱为4组峰,且峰面积比为1∶1∶2∶6的结构简式是______________(写出一种即可)。
(5)由A通过两步反应制备1,3-环己二烯的合成路线为______________________。(其它试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( ) 
A.燃料电池工作时,正极反应为 O2+2H2O+4e═4OH
B.a 极是铁,b 极是铜时,b 极逐渐溶解,a 极上有铜析出
C.a 极是粗铜,b 极是纯铜时,a 极逐渐溶解,b 极上有铜析出
D.a、b 两极均是石墨时,在相同条件下 a 极产生的气体与电池中消耗的 H2 体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究. 请回答:
Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是(填字母序号).
(2)N 极发生反应的电极反应式为 . Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极 均有气体产生,Y 极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═Fe4O2﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 . 该电池正极发生的反应的电极反应式为 . 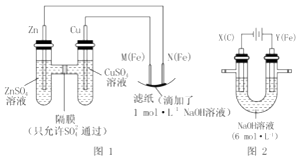
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R 是五种短周期元素,原子序数依次增大。X、Y 两元素最高正价与最低负价之和均为 0;Q 与 X 同主族;Z、R 分别是地壳中含量最高的非金属元素和金属元素。 请回答下列问题:
(1)Y 在元素周期表中的位置为_____。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_____
(3)QX 的电子式为_____;QX 与水反应放出气体的化学方程式为_____
(4)X、Z 两元素所形成化合物的电子式为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)═Na2CO3(s)+![]() O2(g)△H=﹣226kJ/mol
O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.25℃、101 kPa时,1 mol CO和2 mol CO的燃烧热相等
C.2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H<﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断正确的是
A. 碱性:Ca(OH)2 >Mg(OH)2 B. 酸性:H2SO3 > H2CO3
C. 热稳定性:NH3 < PH3 D. 还原性:S2- < F-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com