
【题目】已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)c(OH﹣)= .
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是溶液.
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是溶液.
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液;NH4Cl溶液 .
(5)取5mL NH4Cl溶液,加水稀释至50mL, ![]() (填“增大”、“减小”或“不变”).
(填“增大”、“减小”或“不变”).
(6)在0.10molL﹣1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=molL﹣1(Ksp[Cu(OH)2]=2.2×10﹣20).若在0.1molL﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是molL﹣1 .
【答案】
(1)1×10﹣14
(2)H2SO4
(3)NH4Cl
(4)1×10﹣9mol/L;1×10﹣5mol/L
(5)减小
(6)2.2×10﹣8;0.2
【解析】解:(1)室温下两溶液中水的离子积Kw=c(H+)c(OH﹣)=1×10﹣14 , 所以答案是:1×10﹣14;(2)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液PH变化为6,氯化铵铵根离子水解促进,溶液中氢离子浓度减小的少,溶液pH小于6;pH较大的是硫酸溶液;
所以答案是:H2SO4;(3)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热到90℃,硫酸溶液中氢离子浓度变化不大,氯化铵溶液中水解是吸热反应,加热促进水解,氢离子浓度增大,溶液pH较小的是氯化铵溶液,
所以答案是:NH4Cl;(4)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液中存在离子积常数,硫酸溶液中,c(H+)酸×c(OH﹣)水=10﹣14 , 则水电离的氢氧根离子的浓度c(OH﹣)水=1×10﹣9mol/L;氯化铵溶液中,c(H+)水×c(OH﹣)水剩余=10﹣14 , 则水电离的氢离子浓度为c(H+)水=1×10﹣5mol/L,
所以答案是:1×10﹣9mol/L;1×10﹣5mol/L;(5)取5mL NH4Cl溶液,加水稀释至50mL,铵根离子水解平衡NH4++H2ONH3H2O+H+正向移动,溶液中的铵根离子减小,氢离子增多, ![]() 离子浓度比值减小,
离子浓度比值减小,
所以答案是:减小;(6)pH=8时,c(OH﹣)=10﹣6mol/L,Ksp[Cu(OH)2]=2.2×10﹣20 , 则:c(Cu2+)= ![]() =2.2×10﹣8molL﹣1;在0.1molL﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42﹣)不变,为0.1molL﹣1 , 由电荷守恒可知c(H+)为0.2molL﹣1 ,
=2.2×10﹣8molL﹣1;在0.1molL﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42﹣)不变,为0.1molL﹣1 , 由电荷守恒可知c(H+)为0.2molL﹣1 ,
所以答案是:2.2×10﹣8;0.2.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
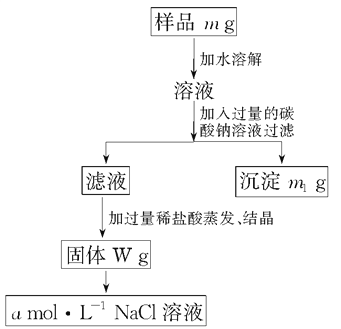
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)仪器a的名称是________________。
(2)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整_____。
(3)实验中他们取6.4g铜片和3mL8mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现娆瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_______________________________;
实验中若有mg铜参加了反应,转移电子的数目为_______________。
②为什么有一定量的硫酸剩余但未能使铜片完全溶解? 你认为的原因是______________________。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是_________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸氢钠固体
(4)为了测定剩余硫酸的物质的量,该兴趣小组通过分液漏斗加入过量的NaNO3溶液,测定烧瓶中产生的气体为物质的量之比为2∶1的NO和NO2混合气体,且完全反应后还有铜片剩余
①请写出加入NaNO3溶液后,容器中发生的离子方程式_______________________________。
②若实验中产生气体的总体积为336mL(标况下),则剩余硫酸的物质的量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10﹣10 , Ksp (BaCO3)=2.6×10﹣9 . 该温度下,下列说法不正确的是( )
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中 ![]() =
= ![]()
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的叙述错误的是
A.用Al(OH)3治疗胃酸过多B.用过氧化钠作潜水供氧剂
C.用氧化镁制作耐高温材料D.用氧化铁制作蓝色外墙涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.是否能通过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 新制氯水可使紫色石蕊试液先变红后褪色
B. 氯水有漂白性是因为HClO的强氧化性
C. 漂白粉是混合物,其有效成分是氯酸钙
D. 新制氯水与久置的氯水中加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com