
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)仪器a的名称是________________。
(2)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整_____。
(3)实验中他们取6.4g铜片和3mL8mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现娆瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_______________________________;
实验中若有mg铜参加了反应,转移电子的数目为_______________。
②为什么有一定量的硫酸剩余但未能使铜片完全溶解? 你认为的原因是______________________。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是_________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸氢钠固体
(4)为了测定剩余硫酸的物质的量,该兴趣小组通过分液漏斗加入过量的NaNO3溶液,测定烧瓶中产生的气体为物质的量之比为2∶1的NO和NO2混合气体,且完全反应后还有铜片剩余
①请写出加入NaNO3溶液后,容器中发生的离子方程式_______________________________。
②若实验中产生气体的总体积为336mL(标况下),则剩余硫酸的物质的量为______________________。
【答案】 圆底烧瓶 ![]() Cu+2H2SO4(浓)
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O mNA/32 铜和稀硫酸不反应 D 7Cu+20H-+6NO3-=7Cu2++2NO2↑+4NO↑+10H2O 0.025mol
CuSO4+SO2↑+2H2O mNA/32 铜和稀硫酸不反应 D 7Cu+20H-+6NO3-=7Cu2++2NO2↑+4NO↑+10H2O 0.025mol
【解析】(1)仪器a的名称是圆底烧瓶。(2)本实验收集气体为二氧化硫,二氧化硫溶于水,选择排空气法,气体密度与相对质量成正比,二氧化硫的相对分子质量为64,比空气的平均相对分子质量29大,所以进气管应伸入集气瓶底部,出气管在集气瓶口部,图为![]() 。(3)实验中他们取6.4g铜片和3mL8mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现娆瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
。(3)实验中他们取6.4g铜片和3mL8mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现娆瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;mg铜的物质的量是m/64 mol,铜元素化合价从0价升高到+2价,因此转移电子的数目为mNA/32。②剩余的硫酸是稀硫酸,稀硫酸与铜不反应;③能证明反应停止后烧瓶中有硫酸剩余,只能证明氢离子的存在才能说明,不能证明硫酸根离子,因为浓硫酸和铜反应生成了硫酸铜;A.硫酸钠溶液不能能证明硫酸根离子存在,也不能证明氢离子的存在,A不符合;B.氯化钡溶液能证明硫酸根离子存在,但不能证明氢离子存在,B不符合;C.银粉和稀硫酸不反应不能证明氢离子的存在,C不符合;D.碳酸氢钠和氢离子反应生成二氧化碳气体,可以用来证明溶液中存在稀硫酸,D符合;答案选D;(4)①在酸性溶液中硝酸根与金属铜反应生成硝酸铜、水以及物质的量之比为2∶1的NO和NO2混合气体,则容器中发生的离子方程式为7Cu+20H++6NO3-=7Cu2++2NO2↑+4NO↑+10H2O。②混合气体的物质的量是0.336L÷22.4L/mol=0.015mol,其中NO2是0.005mol,根据方程式可知氢离子的物质的量是0.05mol,因此剩余硫酸的物质的量是0.025mol。
CuSO4+SO2↑+2H2O;mg铜的物质的量是m/64 mol,铜元素化合价从0价升高到+2价,因此转移电子的数目为mNA/32。②剩余的硫酸是稀硫酸,稀硫酸与铜不反应;③能证明反应停止后烧瓶中有硫酸剩余,只能证明氢离子的存在才能说明,不能证明硫酸根离子,因为浓硫酸和铜反应生成了硫酸铜;A.硫酸钠溶液不能能证明硫酸根离子存在,也不能证明氢离子的存在,A不符合;B.氯化钡溶液能证明硫酸根离子存在,但不能证明氢离子存在,B不符合;C.银粉和稀硫酸不反应不能证明氢离子的存在,C不符合;D.碳酸氢钠和氢离子反应生成二氧化碳气体,可以用来证明溶液中存在稀硫酸,D符合;答案选D;(4)①在酸性溶液中硝酸根与金属铜反应生成硝酸铜、水以及物质的量之比为2∶1的NO和NO2混合气体,则容器中发生的离子方程式为7Cu+20H++6NO3-=7Cu2++2NO2↑+4NO↑+10H2O。②混合气体的物质的量是0.336L÷22.4L/mol=0.015mol,其中NO2是0.005mol,根据方程式可知氢离子的物质的量是0.05mol,因此剩余硫酸的物质的量是0.025mol。


科目:高中化学 来源: 题型:
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3 , 某同学设计并完成如下实验:(所加试剂均过量)已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色. 请回答: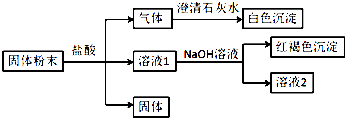
(1)白色沉淀是(填化学式).
(2)生成红褐色沉淀的离子方程式为 .
(3)根据实验现象,固体粉末中一定存在的组分是(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Science 杂志在2017年春节发表了南京理工大学的论文,报道了世界上首个成功合成的五氮阴离子盐 (N5)6(H3O)3(NH4)4Cl(白色固体),这是全氮含能材料中里程碑式的突破。该盐可简略表示如下,下列分析不合理的是( )
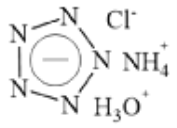
A. 五氮阴离子的化学式为 ![]() B. 该盐中氮元素的化合价均为-3价
B. 该盐中氮元素的化合价均为-3价
C. 该盐遇强碱能释放出NH3 D. 该盐中五氮阴离子具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个相同的密闭容器中分别充入CO2、H2、O2三种气体,当它们的温度和密度都相同,这三种气体的压强(p)从大到小的顺序是
A.p(H2)>p(CO2)>p(O2)B.p(H2)>p(O2)>p(CO2)
C.p(CO2)>p(H2)>p(O2)D.p(O2)>p(CO2)>p(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③
B.①③④
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含原子数相同的是
A. 5.6LCH4(标准状况)和17.5g N2
B. 16gO2和24gO3
C. 224mL H2(标准状况)和0.1mol CO2
D. 标准状况下,11.2LH2O和0.5molSO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)c(OH﹣)= .
(2)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是溶液.
(3)各取5mL上述溶液,分别加热到90℃,pH较小的是溶液.
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液;NH4Cl溶液 .
(5)取5mL NH4Cl溶液,加水稀释至50mL, ![]() (填“增大”、“减小”或“不变”).
(填“增大”、“减小”或“不变”).
(6)在0.10molL﹣1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=molL﹣1(Ksp[Cu(OH)2]=2.2×10﹣20).若在0.1molL﹣1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为1mol/L的NaOH溶液480mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用__滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是____________________。
(2)使用__mL的容量瓶配制此溶液,需要称量NaOH固体的质量为__g。
(3)下列操作会使所配制溶液浓度偏大的有________。
A.容量瓶中原有少量蒸馏水
B.转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D.定容时,俯视观察液面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com