
【题目】在三个相同的密闭容器中分别充入CO2、H2、O2三种气体,当它们的温度和密度都相同,这三种气体的压强(p)从大到小的顺序是
A.p(H2)>p(CO2)>p(O2)B.p(H2)>p(O2)>p(CO2)
C.p(CO2)>p(H2)>p(O2)D.p(O2)>p(CO2)>p(H2)
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】某盐的混合物中含有0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L Clˉ,则SO42ˉ为( )
A.0.1mol/L
B.0.2mol/L
C.0.3mol/L
D.0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol·L-1的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:
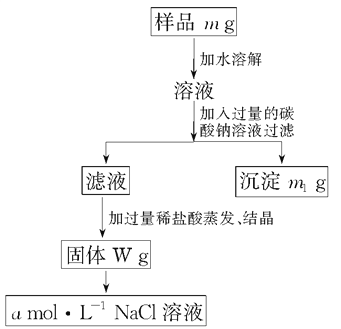
(1)称量粗盐样品m g,所用仪器名称为:_____________。
(2)过滤时,玻璃棒的作用是:__________________。
(3)蒸发操作时应将液体放在__________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,作用是__________________,反应的化学方程式是______________________________________。
(5)在滤液中加入盐酸的作用是____________________________________,
反应的离子程式是_______________________________________。
(6)配制100 mL 1 mol·L-1的NaCl溶液时,应从W g固体中称取NaCl的质量为________,配制时应在________中进行定容。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也令人体会到化学方法在文物保护中的巨大作用。某博物馆修复出土铁器的过程如下。
(1)检测锈蚀产物
主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、________等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ. Fe转化为Fe2+ 。
Ⅱ. Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为_______。
Ⅲ. FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ. Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
![]() (将反应补充完整)___________
(将反应补充完整)___________
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
① 检测洗涤液中Cl-的方法是________。
② 脱氯反应:FeOCl + OH-=FeO(OH) + Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:________。
③ Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙两烧杯溶液中,分别含有大量Cu2+、K+、H+、Cl-、CO32-、OH-6种离子中的3 种,已知甲烧杯的溶液呈碱性,则乙烧杯溶液中大量存在的离子是( )
A. K+、H+、CO32- B. CO32-、OH-、Cl- C. K+、CO32-、Cl- D. Cu2+、H+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是( )
A.熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO ![]()
B.Fe(OH)3的电离:Fe(OH)3?Fe3++3OH﹣
C.H2CO3的电离:H2CO3?2H++CO ![]()
D.水溶液中的NaHSO4电离:NaHSO4═Na++HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:

请回答下列问题:
(1)仪器a的名称是________________。
(2)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整_____。
(3)实验中他们取6.4g铜片和3mL8mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现娆瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_______________________________;
实验中若有mg铜参加了反应,转移电子的数目为_______________。
②为什么有一定量的硫酸剩余但未能使铜片完全溶解? 你认为的原因是______________________。
③下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是_________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸氢钠固体
(4)为了测定剩余硫酸的物质的量,该兴趣小组通过分液漏斗加入过量的NaNO3溶液,测定烧瓶中产生的气体为物质的量之比为2∶1的NO和NO2混合气体,且完全反应后还有铜片剩余
①请写出加入NaNO3溶液后,容器中发生的离子方程式_______________________________。
②若实验中产生气体的总体积为336mL(标况下),则剩余硫酸的物质的量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10﹣10 , Ksp (BaCO3)=2.6×10﹣9 . 该温度下,下列说法不正确的是( )
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中 ![]() =
= ![]()
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com