
����Ŀ��ʵ���������������ʵ���Ũ��Ϊ1mol/L��NaOH��Һ480mL��
��1�����Ƹ���Һ��ʵ�鲽�������
a��������Ҫ�������ƹ����������
b�������������ƹ��壻
c�����ձ��е���Һע������ƿ�У�ϴ���ձ��Ͳ���������ϴ��Һȫ��ת��������ƿ����
d��������������ˮ�ܽ�����õ��������ƹ��壬��ȴ��
e���Ǻ�ƿ�����������µߵ���ҡ�ȣ�
f������������ƿ�м�����ˮ���̶�����1��2cmʱ������__�μ�����ˮ����Һ����̶���������
�����������ȷ����˳����____________________��
��2��ʹ��__mL������ƿ���ƴ���Һ����Ҫ����NaOH���������Ϊ__g��
��3�����в�����ʹ��������ҺŨ��ƫ�����________��
A������ƿ��ԭ����������ˮ
B��ת����Һʱ��û��ϴ�Ӳ��������ܽ��õ��ձ�
C������ҡ�Ⱥ���ʱ����Һ����ڿ̶��ߣ��ּ�ˮ���̶���
D������ʱ�����ӹ۲�Һ��
���𰸡� ��ͷ�ι� abdcfe 500 20.0 D
����������1��f������������ƿ�м�����ˮ���̶�����1��2cmʱ�����ý�ͷ�ιܵμ�����ˮ����Һ����̶�������������һ�����ʵ���Ũ�ȵ���Һ�IJ�������Ϊ���㡢�������ܽ⡢ת�ơ����ݡ�ҡ�ȣ�����ȷ����˳��Ϊabdcfe����2��ʵ����û��480mL��������ƿ��������Ũ��Ϊ1mol/L��NaOH��Һ480mL��Ҫʹ��500mL������ƿ���ƴ���Һ����Ҫ����NaOH���������Ϊ![]() ����3��A������ƿ��ԭ����������ˮ�����ʵ����ʵ�������Һ���������Ӱ�죬���Զ�������Һ�����ʵ���Ũ����Ӱ�죬ѡ��A��ѡ��B��û��ϴ���ձ��ᵼ�����ʵ����ʵ���ƫС������������Һ�����ʵ���Ũ��ƫС��ѡ��B��ѡ��C������ҡ�Ⱥ���ʱ����Һ����ڿ̶��ߣ��ּ�ˮ���̶��ߣ�������ˮƫ�࣬��ҺŨ��ƫС��ѡ��C��ѡ��D������ʱ����Һ�浼����Һ�����ƫС����������Һ�����ʵ���Ũ��ƫ��ѡ��Dѡ����ѡD��
����3��A������ƿ��ԭ����������ˮ�����ʵ����ʵ�������Һ���������Ӱ�죬���Զ�������Һ�����ʵ���Ũ����Ӱ�죬ѡ��A��ѡ��B��û��ϴ���ձ��ᵼ�����ʵ����ʵ���ƫС������������Һ�����ʵ���Ũ��ƫС��ѡ��B��ѡ��C������ҡ�Ⱥ���ʱ����Һ����ڿ̶��ߣ��ּ�ˮ���̶��ߣ�������ˮƫ�࣬��ҺŨ��ƫС��ѡ��C��ѡ��D������ʱ����Һ�浼����Һ�����ƫС����������Һ�����ʵ���Ũ��ƫ��ѡ��Dѡ����ѡD��


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ������ͼ��ʾ��װ�ý���ʵ�飺

��ش��������⣺
��1������a��������________________��
��2��B�������ռ�ʵ���в��������װ�ã���δ�����ܻ�ȫ���뽫װ��ͼ��������_____��
��3��ʵ��������ȡ6.4gͭƬ��3mL8mol��L-1Ũ�������Բ����ƿ�й��ȣ�ֱ����Ӧֹͣ��������ƿ�л���ͭƬʣ�࣬��С���е�ͬѧ��Ϊ����һ����������ʣ�ࡣ
��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��_______________________________��
ʵ��������mgͭ�μ��˷�Ӧ��ת�Ƶ��ӵ���ĿΪ_______________��
��Ϊʲô��һ����������ʣ�൫δ��ʹͭƬ��ȫ�ܽ�? ����Ϊ��ԭ����______________________��
�������Լ��У���֤����Ӧֹͣ����ƿ��������ʣ�����_________����д��ĸ�������
A.��������Һ B.�Ȼ�����Һ C.���� D.̼�����ƹ���
��4��Ϊ�˲ⶨʣ����������ʵ���������ȤС��ͨ����Һ©�����������NaNO3��Һ���ⶨ��ƿ�в���������Ϊ���ʵ���֮��Ϊ2��1��NO��NO2������壬����ȫ��Ӧ����ͭƬʣ��
����д������NaNO3��Һ�������з��������ӷ���ʽ_______________________________��
����ʵ���в�������������Ϊ336mL������£�����ʣ����������ʵ���Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ������ ��
A. ������ˮ��ʹ��ɫʯ����Һ�ȱ�����ɫ
B. ��ˮ��Ư��������ΪHClO��ǿ������
C. Ư���ǻ�������Ч�ɷ��������
D. ������ˮ����õ���ˮ�м�AgNO3��Һ�������ɰ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯ֻ�����ȵ���
A.�������B.Һ̬ˮ���C.���������ˮD.���ڿ�����ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ᣨH3PO4����˵������ȷ���ǣ� ��
A.1molH3PO4������Ϊ98gmol��1
B.H3PO4��Ħ������Ϊ98g
C.9.8g H3PO4����NA��H3PO4����
D.NA��H3PO4���ӵ�����Ϊ98g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol/L��K2CO3��Һ����μ���0.1 mol/L��ϡ����40 mL,��Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����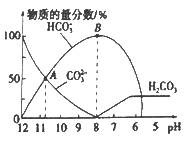
A.����ϡ����ļ��룬��Һ�� ![]() ���ֲ���
���ֲ���
B.����A����㣬Ka2 (H2CO3)��������Ϊ10-3
C.B ����������Һ�У�c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E����Ԫ�ش������Ұ�ԭ������������ԭ������Ϊ5����������Ȼ������˳����������ͼ��ʾ������˵����ȷ���ǣ� �� ![]()
A.EԪ�ص�����ϼ�Ϊ+7��ʱ��DԪ�صĸ����ϼۿ�Ϊ��2��
B.A��OH��nΪǿ��ʱ��B��OH��mҲһ��Ϊǿ��
C.HnDOmΪǿ��ʱ��E�ķǽ�����һ����ǿ
D.HnCOmΪǿ��ʱ��E�ĵ��ʿ�����ǿ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ���ʢ�Т���ɫʯ����Һ ��NaOH��Һ ��Ʒ����Һ �����Ը��������Һ���Թ���ͨ��SO2���塣
��1���Թܢ��е�����___________������Ӧ�Ļ�ѧ����ʽ�ǣ�_________________��
��2���Թܢ��з�����Ӧ�Ļ�ѧ����ʽ�ǣ�_____________________�����ͨ�������SO2��������Ӧ�Ļ�ѧ����ʽΪ��_______________________________��
��3���Թܢ��е�����________���罫����SO2��ĸ���Һ���ȣ�����______________��
��4���Թܢ��е�����____________________��
��5������ʵ���У�SO2���ֳ��������������ʵ���___________�����Թܱ�ţ���ͬ����SO2���ֳ�Ư���Ե���___________��SO2���ֳ���ԭ�Ե���___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���о���ѧ��ӦA+B�TC+D�������仯�����ijͬѧ�������ͼ��ʾװ�ã�����ʢ��A���Թ��еμ��Լ�Bʱ������U�ι��м״�Һ���½��Ҵ�Һ���������Իش��������⣺

��1���÷�ӦΪ __________ ��Ӧ��������������������������
��2��A��B����������C��D�������� __________ ����������������������
��3�������еĻ�ѧ��ͨ����ѧ��Ӧת���� ________________ �ͷų�����
��4����Ӧ�ﻯѧ���������յ����� ______ ���������������������������ﻯѧ���γɷų���������
��5��д��һ���������������Ļ�ѧ����ʽ�� ________________________________________________________________________________
������֪��P4�����ף�s��+5O2��g���TP4O10��s����H=-2 983.2kJmol-1��
P�����ף�s��+![]() O2��g���T
O2��g���T![]() P4O10��s����H=-738.5kJmol-1 ��
P4O10��s����H=-738.5kJmol-1 ��
�����ת��Ϊ�����Ȼ�ѧ����ʽΪ _________________________________________ ����ͬ״���£�����״̬�ϵ͵��� __________ �������ȶ��ԱȺ��� ______ ����������������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com