
【题目】为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:

(1)该反应为 __________ 反应(填“放热”或“吸热”).
(2)A和B的总能量比C和D的总能量 __________ (填“高”或“低”).
(3)物质中的化学能通过化学反应转化成 ________________ 释放出来.
(4)反应物化学键断裂吸收的能量 ______ (填“高”或“低”)于生成物化学键形成放出的能量.
(5)写出一个符合题中条件的化学方程式: ________________________________________________________________________________
Ⅱ.已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2 983.2kJmol-1①
P(红磷,s)+![]() O2(g)═
O2(g)═![]() P4O10(s)△H=-738.5kJmol-1 ②
P4O10(s)△H=-738.5kJmol-1 ②
则白磷转化为红磷的热化学方程式为 _________________________________________ .相同状况下,能量状态较低的是 __________ ;白磷的稳定性比红磷 ______ (填“高”或“低”).
【答案】 放热 高 热能 低 2Al+6HCl=AlCl3+3H2↑ P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol 红磷 低
【解析】Ⅰ.(1)由于发生反应A+B=C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应;(2)由于A+B=C+D的反应为放热反应,所以A和B的总能量比C和D的总能量高;(3)化学变化伴随着物质和能量变化,物质中的化学能通过化学反应通常转化成热能释放出来;(4)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为放热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量;(5)该反应为放热反应,且不需要加热既能够发生,如铝与稀盐酸的反应为放热反应,该反应的化学方程式为2Al+6HCl=AlCl3+3H2↑;
Ⅱ.已知:①P4(白磷,s)+5O2(g)=P4O10(s)△H=-2983.2kJmol-1
②P(红磷,s)+![]() O2(g)=
O2(g)=![]() P4O10(s)△H=-738.5kJmol-1
P4O10(s)△H=-738.5kJmol-1
根据盖斯定律①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,说明白磷转化为红磷是放热反应,相同的状况下,红磷能量比白磷低,由于能量越低物质越稳定,则白磷的稳定性比红磷低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为1mol/L的NaOH溶液480mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用__滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是____________________。
(2)使用__mL的容量瓶配制此溶液,需要称量NaOH固体的质量为__g。
(3)下列操作会使所配制溶液浓度偏大的有________。
A.容量瓶中原有少量蒸馏水
B.转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D.定容时,俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若甲烷与氯气以物质的量之比1:1混合,在光照下得到的有机取代产物是( ) ①CH3Cl、②CH2C12、③CHCl3、④CCl4 .
A.只有①
B.只有③
C.①②③的混合物
D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种重要的化工产品。某工厂用刻蚀印刷电路板产生的碱性废液[含较多[Cu(NH3)4]2+及少量Cu2+、NH4+、NH3和Cl-]制备硫酸铜晶体,流程如下:
(1)通过“中和、沉淀和过滤”可得碱式氯化铜[Cu(OH)Cl]固体,请将生成该固体的反应的离子方程式补充完整:[Cu(NH3)4]2+ +。
(2)制备Cu(OH)Cl沉淀时,溶液的pH对铜元素含量的影响如下图所示:
①若要提高Cu(OH)Cl沉淀的量,应将溶液的pH控制在(填字母序号)。
A. <5.2 B. 5.2~5.8 C. >5.8
②pH< 5.2 时,随pH减小,溶液中铜元素含量增大,其原因用反应的离子方程式可表示为。
(3)“化浆、酸化"过程可得到硫酸铜粗品,发生的反应为Cu(OH)Cl+ 4H2O+ H2SO4= CuSO4·5H2O+ HCl。则硫酸铜粗品中,含铜元素的杂质为 , 检验样品中含有该杂质的方法是:取少量硫酸铜粗品,加入适量水使其充分溶解,。
(4)硫酸铜粗品还需要通过重结晶法进行提纯,具体操作是:将粗晶体溶解于热水中形成饱和溶液,然后加入适量乙醇,搅拌,冷却,过滤并洗涤,得到高纯度的硫酸铜晶体。加入乙醇能够提高硫酸铜的产率,从溶解性角度解释其可能的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;
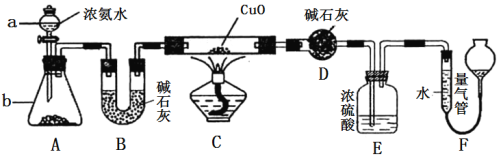
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式 。
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 太阳能电池板与光导纤维的材料主要是晶体硅
B. 可以用澄清石灰水鉴别小苏打溶液与苏打溶液
C. 工业冶炼粗硅的原理:SiO2+C![]() CO2↑+Si
CO2↑+Si
D. 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是( )

A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到氢氧化钠溶液中,以制取Fe(OH)3胶体
D. 如图显示的是树林的晨曦,该现象与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在密闭容器中反应:2SO2+O22SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;bc过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处 . 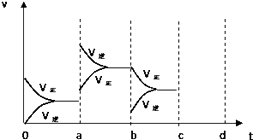
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com