
【题目】下列说法正确的是
A. 太阳能电池板与光导纤维的材料主要是晶体硅
B. 可以用澄清石灰水鉴别小苏打溶液与苏打溶液
C. 工业冶炼粗硅的原理:SiO2+C![]() CO2↑+Si
CO2↑+Si
D. 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如右图所示,下列说法正确的是( ) ![]()
A.E元素的最高化合价为+7价时,D元素的负化合价可为﹣2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中正确的是( )
A.失去电子的反应为还原反应
B.含有氧元素的物质是氧化剂
C.氧化剂得到电子的数目和还原剂失去的电子的数目一定相等
D.氧化剂和还原剂不可能是同一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:

(1)该反应为 __________ 反应(填“放热”或“吸热”).
(2)A和B的总能量比C和D的总能量 __________ (填“高”或“低”).
(3)物质中的化学能通过化学反应转化成 ________________ 释放出来.
(4)反应物化学键断裂吸收的能量 ______ (填“高”或“低”)于生成物化学键形成放出的能量.
(5)写出一个符合题中条件的化学方程式: ________________________________________________________________________________
Ⅱ.已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2 983.2kJmol-1①
P(红磷,s)+![]() O2(g)═
O2(g)═![]() P4O10(s)△H=-738.5kJmol-1 ②
P4O10(s)△H=-738.5kJmol-1 ②
则白磷转化为红磷的热化学方程式为 _________________________________________ .相同状况下,能量状态较低的是 __________ ;白磷的稳定性比红磷 ______ (填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)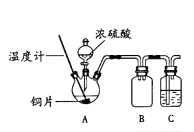
实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是;装置C中盛放的试剂是。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+ , 补充的实验操作及现象是。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业用铝上矿(组成:主要Al2O3、还有Fe2O3、SiO2)冶炼铝流程如下:

完成下列问题:
(1)填主要成分的化学式:滤液A_______;滤渣B______;固体D_______。
(2)流程中每一步加入试剂都足量,X是无色无味无毒气体,X为_______。滤液B通入X气体生成沉淀的离子方程式________________。
(3)滤液A加入足量的NaOH溶液过程中反应的离子方程式(不考虑过量盐酸的反应):________;____________。
(4)铝热反应可以焊接钢轨,写出铝与氧化铁用于焊接钢轨的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A、B两仪器的名称:A________,B________。
(2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入下列溶液中的C______________;D______________。
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
(3)E 中为红色干布条,F 中为红色湿布条,可观察到的现象是_______________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成____________。反应的离子方程式是________________,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变成________。
(5)P处为尾气吸收装置,可选用下列装置中的 ____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.PH=10的Mg(OH)2浊液C(Mg2+)=10﹣8 molL﹣1 (已知Mg(OH)2KSP=1×10﹣16)
B.已知AgClKSP=1.8×10﹣10;Ag2CrO4KSP=1.2×10﹣12则AgCl的溶解度一定比Ag2CrO4大
C.在饱和AgCl溶液中加入NaI固体不会发生变化
D.Fe3+在酸性溶液中一定不会生成Fe(OH)3沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com