
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
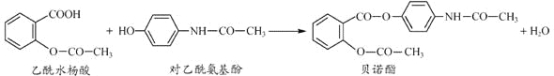
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示)。除去杂质的实验方案如下:

(1)B溶液中存在的阳离子有_________,阴离子有_________。
(2)C中所含物质的化学式是_________。
(3)D中加入适量盐酸后,大量减少的微粒有__________。
(4)①和②不能调换顺序的理由是__________。
(5)某同学认为可将上方案进行改进:①加入过量BaCO3 ②加入适量盐酸,即可达到除杂的目的,而且步骤更为简便。请评价这种方法是否正确______,说明理由_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===![]() +2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
+2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++ 7H2O,有关说法正确的是
A. 还原性Cr3+>Fe2+>SO2
B. 氧化性Cr2O72->SO2>Fe3+
C. 两个反应中Fe2(SO4)3均作还原剂
D. Cr2O72-能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应现象,回答问题:
(1)向氯化铜溶液中滴加氢氧化钠溶液,其现象是________________________________,离子反应方程式是________________________________。
(2)向碳酸氢钠溶液中滴加稀硫酸,其现象是________________________________________,离子反应方程式是____________________________________。
(3)稀硝酸与氢氧化钾溶液混合,其现象是_________________________________________,离子反应方程式是______________________________________。
(4)上述三个反应均属于______________反应(填基本反应类型),反应发生的条件的不同点是第一个生成________________,第二个生成______________,第三个生成______________;相同点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________→E,确定还原产物中有二氧化氮的现象是______________________________________,实验中要多次使用装置F,第二次使用F的目的是______________________________________________。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对熟石灰的悬浊液加热,悬浊液中固体质量增加
B. 实验室中常用排饱和食盐水的方式收集氯气
C. 打开汽水瓶,有气泡从溶液中冒出
D. 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com