
����Ŀ����ijNaCl��Һ��Ʒ�к���Na2SO4��CaCl2����(����Һ��X��ʾ)����ȥ���ʵ�ʵ�鷽��������

(1)B��Һ�д��ڵ���������_________����������_________��
(2)C���������ʵĻ�ѧʽ��_________��
(3)D�м�����������������ٵ�����__________��
(4)�ٺ͢ڲ��ܵ���˳���������__________��
(5)ijͬѧ��Ϊ�ɽ��Ϸ������иĽ����ټ������BaCO3 �ڼ����������ᣬ���ɴﵽ���ӵ�Ŀ�ģ����Ҳ����Ϊ��㡣���������ַ����Ƿ���ȷ______��˵������_________��
���𰸡�Na����Ba2+��Ca2+ Cl- CaCO3 BaCO3 CO32- �ٺ͢ڵ���˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У�δ��ȥ ����ȷ ��ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ��
��������
ijNaCl��Һ��Ʒ�к���Na2SO4��CaCl2���ʣ�����BaCl2������BaSO4��ɫ���������˺���ҺB�к���NaCl ��CaCl2 ��BaCl2�ɷ֣��ټ��������Na2CO3���ɳ���CΪBaCO3��CaCO3�����˺���ҺD����NaCl ��Na2CO3���ټ�������HCl��Һ����Һ��ΪNaCl��
(1)�ۺ���������֪: B�к���NaCl ��CaCl2 ��BaCl2�ɷ֣�����B��Һ�д��ڵ���������Na����Ba2+��Ca2+����������Cl-���𰸣�Na����Ba2+��Ca2+ ��Cl-��
(2) �ۺ���������֪: ���������Na2CO3���ɳ���CΪBaCO3��CaCO3������C�к��к��е����ʵĻ�ѧʽ����CaCO3 ��BaCO3���𰸣�CaCO3 ��BaCO3��
(3) �ۺ���������֪D����NaCl ��Na2CO3���������������2H++ CO32-=H2O+CO2![]() ,�������ٵ�����CO32-���𰸣�CO32-��
,�������ٵ�����CO32-���𰸣�CO32-��
(4) ����������˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У����ܳ�ȥ�������������ܵ�������: ����������˳����ȻҲ���Գ�ȥCa2+ ��SO42-�����Ǻ�����BaCl2��Һ�е�Ba2+�����ʵ���ʽ������Һ�У�δ��ȥ��
(5)��ͬѧ�ĸĽ���������������ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ�����𰸣�����ȷ����ΪBaCO3������ˮ����Na2SO4��CaCl2���Է�����Ӧ���������ȥ���ʵ�Ŀ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼����(Na2CO3��3H2O2) ��ϴ�ӡ���֯��ҽҩ�������й㷺Ӧ�á�һ���Ʊ���̼���ƵĹ���������ͼ��ʾ��

��1��̼����ˮ��Һ�ʼ��Ե�ԭ����____________(�����ӷ���ʽ��ʾ)��Ϊ��ǿϴ��Ч�����ɲ�ȡ��Ĵ�ʩ��________________��
��2����̼���������ֽ⣬д����Ӧ�Ļ�ѧ����ʽ:__________________
��3���ȶ���������_____(�����)��
A.Na2SO3 B.Na2SiO3 C.H2SO4 D.MnO2
��4���ᾧʱ����ʳ�ε�Ŀ����_________,ĸҺ�п�ѭ��ʹ�õ�������_________(�ѧʽ)��
��5����ҵ�ϳ��Թ�̼���Ʋ�Ʒ�л��Ժ�����![]() ��������Ʒ���ӣ�13%���ϵ�Ϊ����Ʒ����Ʒ�л����������IJⶨ����: ����m g ��Ʒ����250mL ��ƿ����100mL 0.5mol/L������ȫ�ܽ⣬������c mol/L�ĸ�����ر���Һ���еζ������ζ��յ㣬������MnO2����ԭΪMn2+,�������εζ���������ı���Һƽ�����ΪV1mL�����⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬���ĸ��������Һ�����ΪV2 mL���ò�Ʒ����������Ϊ________(�ô���ʽ��ʾ)��
��������Ʒ���ӣ�13%���ϵ�Ϊ����Ʒ����Ʒ�л����������IJⶨ����: ����m g ��Ʒ����250mL ��ƿ����100mL 0.5mol/L������ȫ�ܽ⣬������c mol/L�ĸ�����ر���Һ���еζ������ζ��յ㣬������MnO2����ԭΪMn2+,�������εζ���������ı���Һƽ�����ΪV1mL�����⣬�ڲ�����Ʒ������°����������̽��пհ�ʵ�飬���ĸ��������Һ�����ΪV2 mL���ò�Ʒ����������Ϊ________(�ô���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ʱ����Ũ��Ϊm molL��1��CH3COOH��Һ��n molL��1 NaOH��Һ�������ϣ���Ϻ���Һ��pH=7��m��n�Ĵ�С��ϵ��m____ n�����������������=������ͬ��������pH=2��CH3COOH��Һ��pH=12��NaOH��Һ�������ϣ������Һ��pH______ 7��
��2�������õ���ĭ�������װ��ҩƷ����������Һ��̼��������Һ�������ӷ���ʽ��ʾ�����ʱ�����ķ�Ӧ_________________.
��3��������ijǿ����ҺpH=a��ǿ����ҺpH=b����֪a+b=12�������Һ���pH=7��������Һ���V1�ͼ���Һ���V2�Ĺ�ϵΪ_________.
��4������ʱKsp[Cu(OH)2]=2.2��10��20����Cu(OH)2����2.2mol/L CuCl2��Һ���γ�ƽ����Һ��pHΪ____.
��5�����ʵ���Ũ����ͬ��������Һ��(NH4)2CO3��(NH4)2SO4��NH4HCO3��NH4HSO4��NH4Cl��NH3H2O��c��NH4+����С���������˳����___________������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ����
A. 0.1 mol N2��������2.8 g
B. Mg��Ħ��������24 g/mol
C. 2 L 0.1mol��L��1NaCl��Һ�У�c(Na��)��0.2mol��L��1
D. ��״���£�11.2 L O2���е�ԭ����ĿԼΪ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ϴ���ķ�ͭм��ԭ�����Ʊ�����ͭ���ӽ�Լԭ����������Ⱦ�����ĽǶȿ��ǣ��˲�ȡ�ķ�����
A. Cu+HNO3(Ũ)��Cu(NO3) 2
B. Cu+HNO3(ϡ)��Cu(NO3) 2
C. Cu ![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
D. Cu ![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)��H��0 ����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
2CO2(g)+S(l)��H��0 ����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����
A. ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ���
B. ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ�
C. ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת����
D. �����������䣬ʹ�ò�ͬ�������÷�Ӧƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�����ѭ����ת������������������Ҫ�ļ�ֵ��
I��(1)д��ʵ�����Ʊ������Ļ�ѧ����ʽ________ ��
II��������Ҫ�Ļ���ԭ�ϡ�ij�����ð����������ε���������ͼ��ʾ��

(2)�豸1��3�з�����Ӧ�Ļ�ѧ����ʽ�ֱ���______�� ________ ���豸2��ͨ�������A��________��
III��������ˮ��ȥ���ǵ�ǰ��ѧ�о����ȵ����⡣������ˮ�еĵ�Ԫ�ض���NH4+��NH3H2O����ʽ���ڡ�ij��������������ˮ���������£�

(3)���̢ٵ�Ŀ���ǽ�NH4+ת��ΪNH3����ͨ�������������������������д��NH4+ת��ΪNH3�����ӷ���ʽ________ ��
(4)���̢ڼ���NaClO��Һ�ɽ�����ת��Ϊ�����ʣ���Ӧ��Ԫ�ء���Ԫ�ص����ʻ�ѧʽ�ֱ�Ϊ___��_______��
(5)�����ȷ�ˮ����Ҫ�ɷ���NaClO�Լ�HClO��X��ѡ������������Һ�Դﵽȥ�����ȵ�Ŀ��(�����)_________��
a��KOH b��Na2SO3 c��KMnO4 D��NaCl
д������һ����Ӧ�����ӷ���ʽ__________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ�ﱴŵ����������ˮ����Ͷ�������������һ�������·�Ӧ�Ƶã�
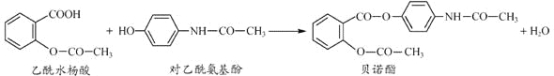
�����й�������ȷ���ǣ� ��
A. ��ŵ�������������ֺ���������
B. ����FeCl3��Һ��������ˮ����Ͷ�����������
C. ����ˮ����Ͷ����������Ӿ�����NaHCO3��Һ��Ӧ
D. ��ŵ��������NaOH ��Һ���ȣ�������������ˮ�����ƺͶ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���Ľṹ���ü���ʽ��ʾ����CH3-CH=CH-CH3�ɱ�ʾΪ![]() ����һ���л���X�ļ���ʽ��ͼ��ʾ��
����һ���л���X�ļ���ʽ��ͼ��ʾ��

(1)X�ķ���ʽΪ_______________________��
(2)�л���Y��X��ͬ���칹�壬�����ڷ����廯�����Y�Ľṹ��ʽ��_____________��
(3)Y��һ�������¿ɷ�����Ӧ���ɸ߷��ӻ�����÷�Ӧ�Ļ�ѧ����ʽ��_________________��
(4)Y��������ˮ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com