
二元弱酸是分步电离的,25时碳酸和草酸的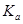 如下表:
如下表:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
(1)B C (2)2H++CO32-=H2O+CO2↑ Ca2++CO32-=CaCO3↓ 10-4
解析试题分析:(1)因为H2C2O4的二级电离平衡常数Ka2=5.42×10-5> H2CO3的二级电离平衡常数Ka2=5.6×10-11。所以在这四种溶液c(H+)最大的是0.1 mol/L的NaHC2O4溶液。正确选项为B.电离平衡常数越小,其钠盐水解的程度就越大。溶液的碱性就越强。由于Ka2(H2C2O4)=5.42×10-5> 5.6×10-11= Ka2(H2CO3),所以c(OH-)最大的是0.1 mol/L的Na2CO3溶液。正确选项为C.(2)在反应开始时由于溶液的pH略大于2,说明溶液中含有过量稀盐酸电离产生大量的H+。此时滴入碳酸钠溶液时发生反应的离子方程式为2H++CO32-=H2O+CO2↑;在PH=7,溶液呈中性时发生的反应为CaCl2+Na2CO3="2NaCl+" CaCO3↓.反应的离子方程式为Ca2++CO32-=CaCO3↓。当该反应发生完全后继续加入Na2CO3,则是Na2CO3和NaCl的混合溶液。NaCl是强酸强碱盐,不发生水解反应,而Na2CO3是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,使溶液显碱性。在D点溶液的pH=10,则c(H+)=10-10mol/L.由于H+you 消耗,所以水电离产生的OH-的浓度为:c(OH-)=Kw÷c(H+)=10-4mol/L.所以c(H+)(水)= c(OH-)(水)= 10-4mol/L。
考点:考查盐的水解、电离平衡常数及图像法的应用。主要包括盐溶液中的c(H+)、c(OH-)\的比较及混合溶液中离子方程式的书写及盐水解时水电离产生的离子浓度的问题。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
| |
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
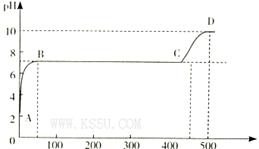
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A~G各物质间的关系如图,其中B、D为气态单质。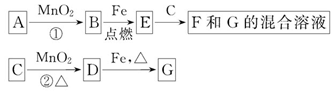
请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_________;若只能在加热情况下进行,则反应物A应为______________;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。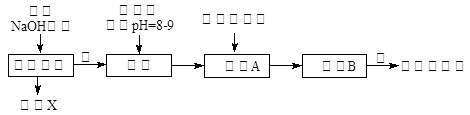
(1)镁铝合金中加NaOH溶液的离子反应方程式为 ,画出金属X的原子结构示意图 ,固体A的化学式为 ;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、 。 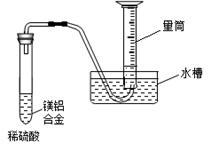
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下: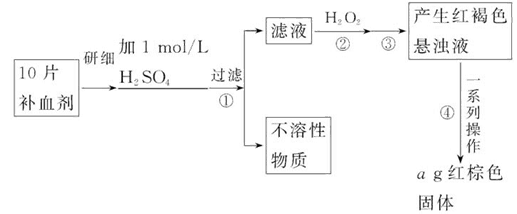
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加_______,该过程的现象为:__________________________________________。
(2)步骤②加入过量H2O2的目的是:____________________________________。
(3)步骤③中反应的离子方程式是:_____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______、灼烧、_______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示: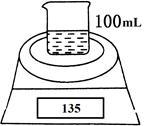
| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是中学化学中常见的单质, D为地壳中含量最多的金属;甲、乙、丙为化合物,其中甲为有磁性的黑色晶体,乙在常温常压下为无色液体。各物质的转化关系如下: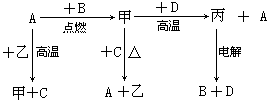
(1)组成D的元素在周期表中的位置是 。
(2)若用一种反应类型概括上述转化中所涉及到的全部反应,该反应类型是 。
(3)在上述电解反应中,阳极的电极反应式是 。
(4)甲和D反应的化学方程式是 。
(5)D的某种盐常用于净水,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com