
| A. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| B. | 15gCH3+(碳正离子)中含有的电子数为10NA | |
| C. | 标准状况下,0.5mol氦气含有的电子数为NA | |
| D. | 0.1L 2mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA |
分析 A.氯气发生氧化还原反应可以是自身氧化还原反应,也可以只做氧化剂;
B.1个CH3+(碳正离子)含有8个电子;
C.氦气为氮原子分子;
D.硫离子为弱根离子,部分发生水解.
解答 解:A.0.1mol氯气参加氧化还原反应,自身氧化还原反应转移电子0.1mol,也可以只做氧化剂转移的电子数为0.2NA,故A错误;
B.1个CH3+(碳正离子)含有8个电子,15gCH3+(碳正离子)的物质的量为1mol,含有电子数为8NA,故B错误;
C.标准状况下,0.5mol氦气含有的电子数为0.5mol×2NA=NA,故C正确;
D.0.1L 2mol•L-1的(NH4)2S溶液含有硫化铵的物质的量为0.2mol,但是硫离子为弱根离子,部分发生水解,所以含有的S2-数目小于0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意盐类的水解规律,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 若n(HA)=n(NaOH),则a+b≥14 | B. | 若n(HA)>n(NaOH),则a+b<14 | ||
| C. | 若混合后溶液pH=7,则n(HA)≥n(NaOH) | D. | 若混合后溶液pH>7,则n(HA)<n(NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向H2O2溶液中加入MnO2:2H2O2+4H++MnO2=O2↑+Mn2++4H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水、氯水、氨水均为混合物 | |
| B. | SiO2不能和水反应,所以它不是酸性氧化物 | |
| C. | 液氨、液态氯化氢都是非电解质 | |
| D. | 冰、干冰、冰醋酸都是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:Y<M | |
| B. | 简单离子半径由大到小的顺序是:M>Y>Z | |
| C. | 化合物Z2Y2 中含有离子键和非极性共价键 | |
| D. | 等浓度的X2M与Z2M的溶液中,水的电离程度:X2M<Z2M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | 将二氧化硫通入溴水中,溴水褪色 | 二氧化硫有漂白性 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸反应速率 |
| D | 淀粉与稀硫酸共热,再加银氨溶液水浴加热,无银镜生成 | 淀粉没有水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
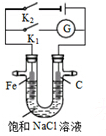
| A. | K1闭合,石墨棒上发生的反应为2H++2e→H2↑ | |
| B. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| C. | K2闭合,石墨棒周围溶液pH逐渐升高 | |
| D. | K1闭合,电路中通过0.004NA个电子时,石墨棒上产生0.001mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
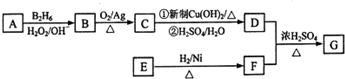
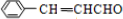 .
.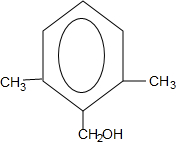 或
或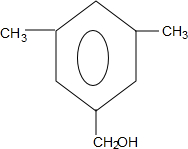 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | C | C. | O2 | D. | Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com