
| A、向水中加入少量固体Na2CO3,平衡逆向移动,c(OH-)增大 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C、向水中加入少量固体NaOH,平衡逆向移动,c(H+)降低,KW减小 |
| D、将水加热,KW增大,pH不变 |


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| A、中子数为1 |
| B、质子数为2 |
| C、质量数为3 |
D、原子结构示意图是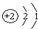 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子中能量相近的某些轨道,在成键时能重新组合成能量相等的新轨道 |
| B、杂化轨道的数目与杂化前的轨道数目可以相等,也可以不等 |
| C、杂化轨道成键时,要满足原子轨道最大重叠原理、最小排斥原理 |
| D、杂化轨道只能用于形成σ键或容纳孤电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲组 | B、乙组 | C、丙组 | D、丁组 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中的C、H、O的个数比为1:2:3 |
| B、该有机物的相对分子质量为28 |
| C、分子中C、H个数比为1:2 |
| D、该分子中肯定不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英可用来制作工艺品 |
| B、硅单质可用来制造太阳能电池 |
| C、硅单质是制造玻璃的主要原料 |
| D、二氧化硅是制造光导纤维的材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com