
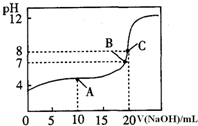
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O
CH3COOH+OH-,右移;NaOH溶液不管加热到多少度它的PH都不变,而CH3COONa溶液加热的话,会促进CH3COONa的水解,所以CH3COONa溶液pH会增大,故答案为:>;加水稀释使平衡CH3COO-+H2O CH3COOH+OH-,右移;>;
CH3COOH+OH-,右移;>;| C(H+)?C(A-) |
| C(HA) |
| 10-3×10-3 |
| 0.1-10-3 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
 有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.
有A、B、C、D四种短周期主族元素,其原子序数依次增大.A、B可形成A2B和A2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物.完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
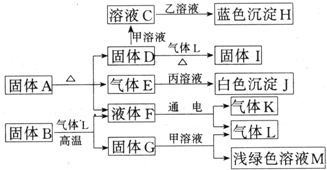
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下呈中性的溶液:Fe3+、Na+、Cl-、SO42- |
| B、1mol/L的NaAlO2溶液:NH3?H2O、CO32-、K+、SiO32- |
| C、与铝单质反应产生氢气的溶液:Na+、K+、NO3-、Mg2+ |
| D、由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前者为放热反应 |
| B、红磷的能量比白磷低 |
| C、金刚石比石墨稳定 |
| D、上述变化都为物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com