
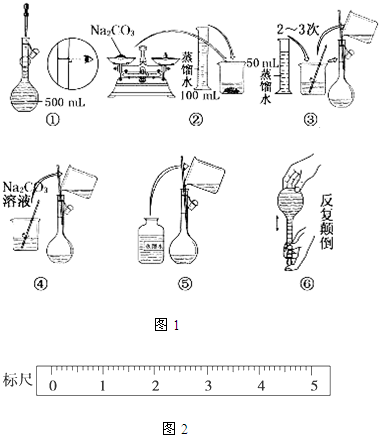
| 7.40g |
| 74g/mol |
| 0.17g |
| 74g/mol |
| 0.002297mol×2 |
| 0.1L |
| 7.40g |
| 74g/mol |


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2 |
| 9 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 TiO2在光照射下可使水分解:2H2O
TiO2在光照射下可使水分解:2H2O
| ||
| 光 |
| A、该装置中TiO2电极上发生还原反应 |
| B、铂电极上发生的反应为:2H++2e-═H2↑ |
| C、该装置工作时,电流由TiO2电极经R流向铂电极 |
| D、该装置工作时,TiO2电极附近溶液的pH变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
| B、电解精炼铜时,阳极泥中常含有金属金、银、锌等 |
| C、可充电电池放电时,化学能转变为电能 |
| D、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有③ |
| C、只有②③ | D、只有①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com