
【题目】某化合物的结构如图所示,W、X、Y均为短周期元素,W+离子为短周期金属阳离子中半径最大的元素,Y元素形成的单质是理想的气体燃料。下列说法不正确的是( )
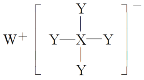
A.该化合物是强还原剂
B.Y-与Li+具有相同的电子层结构
C.X可能是碳元素或者是硅元素
D.原子半径大小关系为:W>X>Y
【答案】C
【解析】
W、X、Y均为短周期元素,W+离子为短周期金属阳离子中半径最大的元素,则W为Na;Y元素形成的单质是理想的气体燃料,则Y为H;由结构示意图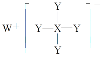 ,可知X最外电子层为3,则X为B或Al,以此分析。
,可知X最外电子层为3,则X为B或Al,以此分析。
W、X、Y均为短周期元素,W+离子为短周期金属阳离子中半径最大的元素,则W为Na;Y元素形成的单质是理想的气体燃料,则Y为H;由结构示意图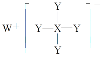 ,可知X最外电子层为3,则X为B或Al。
,可知X最外电子层为3,则X为B或Al。
A. 该化合物为NaBH4或氢化铝钠,其中H为-1价,是强还原剂故A正确;
B. H-与Li+具有相同的电子层结构,故B正确;
C. X为B或Al,故C错误;
D. 原子半径大小关系为:Na>B(或Al)>H,故D正确;
故答案选:C。


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】一种有毒性物质A, 其含碳76.6%、氢6.38%。氧17.02%(均为质量分数),它们的相对分子质量是乙烷的3.13倍,试回答以下问题。
(1)确定该有机物A的分子式为____________。
(2)用核磁共振仪处理该化合物,得到核磁共振氢谱图,图中出现四组峰,其四个峰的面积之比是1:2:2:1,则有机物的名称为____________。
(3)该有机物A呈现微弱的酸性,可与氢氧化钠反应,试写出该反应的离子方程式____________。
(4)为探究该有机物的酸性强弱,常做以下实验,向该物质的悬浊液中滴加Na2CO3溶液,发现溶液变澄清,试写出该反应的化学方程式_______________________________________________。
(5) 比A多一个碳原子,且属于A的同系物,其苯环上一氯代物有两种的物质是:__________________(写结构简式),该物质能使饱和的溴水褪色,试写出其与溴水完全反应的化学反应方程式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是一种医药中间体。其结构简式如图所示,下列有关该物质的说法正确的是
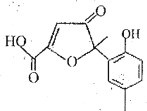
A.该化合物分子中只含一个手性碳原子
B.该化合物与NaHCO3溶液作用有CO2气体放出
C.1mol该化合物与足量溴水反应,消耗3molBr2
D.在一定条件下,该化合物与HCHO能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高钛渣(主要成分为Ti3O5,含少量SiO2、FeO、Fe2O3)为原料制备白色颜料TiO2的一种工艺流程如下:

已知:Na2TiO3难溶于碱性溶液;H2TiO3中的杂质Fe2+比Fe3+更易水洗除去。
(1)熔盐:
①为加快反应速率,在维持反应物颗粒大小、反应温度一定的条件下,可采取的措施是__________。
②NaOH固体与Ti3O5在空气中加热至500~550 ℃时生成Na2TiO3,该反应的化学方程式为_________。
(2)过滤:
①“滤液”中主要溶质为NaOH,还含有少量________(填化学式)。
②除杂后的滤液中获得的NaOH可循环利用,则“水浸”时,用水量不宜过大的主要原因是_________。
(3)水解:“酸溶”后获得的TiOSO4经加热煮沸,生成难溶于水的H2TiO3,该反应的化学方程式为______。
(4)脱色:H2TiO3中因存在少量Fe(OH)3而影响TiO2产品的颜色,“脱色”步骤中Ti2(SO4)3的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的Q、W、X、Y、Z五种元素中,Q、W、X是分别位于前三个周期且原子最外层电子数之和为10的主族元素,W与Y同主族、X和Y同周期;X是地壳中含量最高的金属元素、Z存在胆矾之中。下列关于它们的叙述合理的是
A. 最高价氧化物对应水化物的碱性比X比Z弱
B. W与X简单离子半径后者更大
C. W、Y两种元素最高化合价相同
D. X、Z两种金属在两千多年前就被我们祖先广泛使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.某温度下,1 L pH = 6 的纯水中含 OH一为10-8mol
B.25℃ 时,向0. 1 mo lL-1 CH3COONa 溶液中加入少量水,溶液中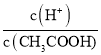 减小
减小
C.25℃时,将 V1 L pH = 11的 NaOH溶液与V2 L pH = 3 的H A 溶液混合,溶液显中性,则V1 ≤V2
D.25℃时,将 a molL-1 氨水与0.01 molL- 1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示 NH3H2O)的电离常数 Kb = ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
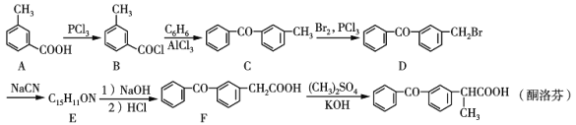
(1)化合物D中所含官能团的名称为___和____。
(2)化合物E的结构简式为__________;由B→C的反应类型是____
(3)写出C→D的反应方程式:_____________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有____种。
Ⅰ.属于芳香族化合物 Ⅱ.能发生银镜反应Ⅲ.其核磁共振氢谱有5组峰,且面积比为1∶1∶1∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
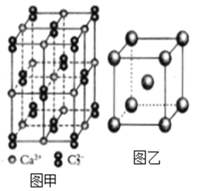
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com