
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
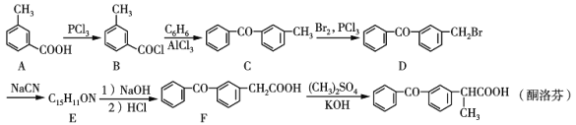
(1)化合物D中所含官能团的名称为___和____。
(2)化合物E的结构简式为__________;由B→C的反应类型是____
(3)写出C→D的反应方程式:_____________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有____种。
Ⅰ.属于芳香族化合物 Ⅱ.能发生银镜反应Ⅲ.其核磁共振氢谱有5组峰,且面积比为1∶1∶1∶1∶3
【答案】羰基(酮基) 溴原子 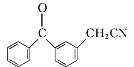 取代反应
取代反应 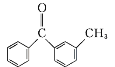 +Br2
+Br2![]()
 +HBr 10
+HBr 10
【解析】
A转化为B,-COOH转化为-COCl,B与苯发生取代反应生成C,C与Br2发生取代反应生成D,根据F与D的结构简式可知, D中-Br被-CN取代生成E,推出E的结构简式为: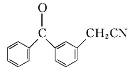 ,E发生水解反应生成F,F发生取代反应生成酮洛芬,据此分析作答。
,E发生水解反应生成F,F发生取代反应生成酮洛芬,据此分析作答。
(1)化合物D(![]() )中所含官能团的名称为羰基(酮基)和溴原子;
)中所含官能团的名称为羰基(酮基)和溴原子;
(2) 对比D、F结构,结合E的分子式,可知D中-Br被-CN取代生成E,则E的结构简式为: ;对比B、C结构简式可知,B中-Cl为苯基取代生成C,同时还生成HCl,由B→C的反应类型是取代反应,故答案为:
;对比B、C结构简式可知,B中-Cl为苯基取代生成C,同时还生成HCl,由B→C的反应类型是取代反应,故答案为: ;取代反应;
;取代反应;
(3)比C、D的结构可知,C中甲基上H原子被Br原子取代生成D,属于取代反应,故其反应方程式为: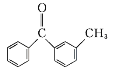 +Br2
+Br2![]()
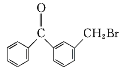 +HBr;
+HBr;
(4)B的同分异构体属于芳香族化合物说明含有苯环,能发生银镜反应,说明分子结构中存在醛基;分子中含有其核磁共振氢谱有5组峰,说明分子结构中存在5种不同化学环境的氢原子,且面积比为1:1:1:1:3,说明苯环侧链上含有3个,根据定二移一原则,符合条件的同分异构体有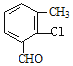 、
、![]() 、
、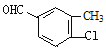 、
、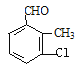 、
、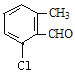 、
、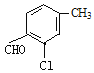 、
、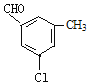 、
、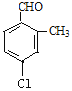 、
、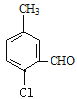 、
、 共有10种同分异构体,故答案为:10。
共有10种同分异构体,故答案为:10。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成CO2和水。将12g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g;再通过碱石灰,碱石灰增重26.4g,该有机物的分子式为( )
A. C4H10OB. C2H6OC. C3H8OD. C2H4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构如图所示,W、X、Y均为短周期元素,W+离子为短周期金属阳离子中半径最大的元素,Y元素形成的单质是理想的气体燃料。下列说法不正确的是( )
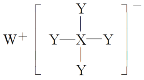
A.该化合物是强还原剂
B.Y-与Li+具有相同的电子层结构
C.X可能是碳元素或者是硅元素
D.原子半径大小关系为:W>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.76g铜镁合金完全溶解于一定浓度的硝酸中,得到NO和NO2标准状况下896mL的混合气体,向反应后的溶液中加入lmol/L的NaOH溶液,当金属离子全部沉淀时,得到3.12g沉淀。下列说法不正确的是
A. 合金中铜镁物质的最之比为1:1
B. 产生的NO和NO2的体积之比为1:1
C. 得到3.12g沉淀时,加入NnOH溶液体积一定是80mL
D. 1.76g该合金与足量盐酸反应,可生成标准状况下448mL气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用图示装置进行实验(夹持仪器已略去,气密性已检验)。

回答下列问题:
(1)仪器a的名称:___________________。
(2)打开弹簧夹1,关闭弹簧夹2,旋开仪器a的活塞滴加盐酸。一段时间后,A中现象是________;原因是________。
(3)关闭弹簧夹1,打开弹簧夹2,D中出现白色胶状沉淀,X是________(填化学式),D中发生反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
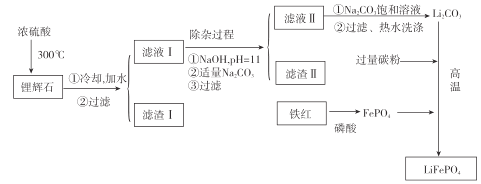
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 的盐酸滴定 20.00 mL 未知浓度的氨水,滴定曲线如图所示,滴加 20. 00 mL 盐酸时所得溶液中 c (Cl-)= c( NH4+)+c(NH3·H2O)+c( NH3)。下列说法错误的是
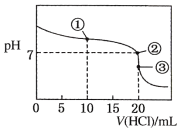
A.点①溶液中 c( NH4+)+c ( NH3·H2O)+c(NH3)=2c (Cl-)
B.点②溶液中 c( NH4+)=c (Cl-)
C.点③溶液中 c (Cl-)> c( H+)>c (NH4+)>c(OH-)
D.该氨水的浓度为 0.1000mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苏合香醇可用作食用香精,其结构简式如图所示
![]()
(1)苏合香醇的分子式为________,它不能发生的有机反应类型有________(填数字序号)。
①取代反应 ②加成反应 ③消去反应
④加聚反应 ⑤氧化反应 ⑥还原反应
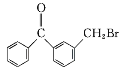
有机物丙是一种香料,其合成路线如下图。其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰;乙与苏合香醇互为同系物。
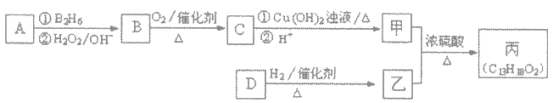
已知:![]()
![]()
![]()
(2)按照系统命名法,A的名称是_________。
(3)C与新制Cu(OH)2悬浊液反应的化学方程式为______。
(4)丙中含有两个-CH3,在催化剂存在下1mol D与2mol H2可以反应生成乙,且D可发生银镜反应,则D的结构简式为_____________。
(5)甲与乙反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com