
| △c |
| △t |
| 1.8mol/L |
| 10min |
| c2(NH3) |
| c(N2)c3(H2) |
| 1.22 |
| 0.4×1.03 |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、常温下,46g NO2含有2NA个氧原子 |
| B、常温常压下,22.4LCCl4含有个NA个CCl4分子 |
| C、标准状况下,22.4L空气含有NA个单质分子 |
| D、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ?mol-1 |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| C、已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ?mol-1,则H2的燃烧热为285.8kJ?mol-1 |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
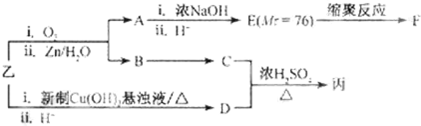
| 一定条件 |
| I |
| O2/Cu |
| △ |
| 一定条件 |
| Ⅱ |
| i.O3 |
| ii.Zn/H2O |
| i.浓NaOH |
| ii.H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com