
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
| 催化剂 |
| △ |
| 0.3mol | ||
|


科目:高中化学 来源: 题型:
| A、热化学方程式未注明温度和压强时,△H表示标准状况下的数据 |
| B、热化学方程式中的化学计量数只代表反应物或生成物的物质的量 |
| C、在加热或点燃条件下才能进行的化学反应既可以为放热反应,也可以为吸热反应 |
| D、同一化学反应化学计量数不同,△H值不同.化学计量数相同而状态不同,△H值也不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
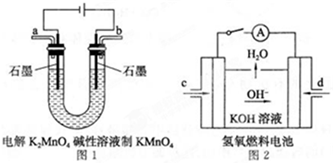
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据化合价Fe3O4可表示为FeO?Fe2O3,则Fe3I8也可表示为FeI2?2FeI3 |
| B、CaC2能水解:CaC2+2H2O→Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O→4Al(OH)3↓+3CH4↑ |
| C、O2与Cu反应加热生成CuO,则S与Cu反应加热生成CuS |
| D、SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加少量烧碱溶液 | B、升高温度 |
| C、加少量冰醋酸 | D、加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质的熔、沸点逐渐降低 |
| B、卤素离子的还原性逐渐增强 |
| C、单质的氧化性逐渐增强 |
| D、气态氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、乙烯和植物油都能使酸性高锰酸钾褪色 |
| B、乙醇、乙烷、乙酸都可以与钠反应生成氢气 |
C、聚丙烯的结构简式为: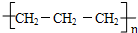 |
| D、用灼烧闻气味的方法可以区分纯棉织物和纯毛织物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com