
| A、单质的熔、沸点逐渐降低 |
| B、卤素离子的还原性逐渐增强 |
| C、单质的氧化性逐渐增强 |
| D、气态氢化物的稳定性逐渐增强 |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、绿色化学的核心是利用化学原理治理环境污染 |
| C、将煤气化或液化,获得清洁燃料 |
| D、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe(OH)2 |
| B、放电时,每转移2 mol 电子,正极上有1 mol Ni2O3被氧化 |
| C、充电时,阳极上的电极反应式是:2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O |
| D、该蓄电池的电极必须是浸在某种碱性电解质溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔、乙醛、乙二醇 |
| B、乙烯、乙酸、葡萄糖 |
| C、乙烯、丁烯、环已烷 |
| D、乙烯、乙醇、丙烯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
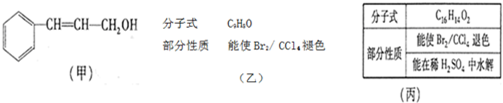
| 一定条件 |
| I |
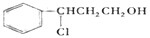
| O2/Cu |
| △ |
| 一定条件 |
| Ⅱ |
| i.O3 |
| ii.Zn/H2O |
| i.浓NaOH |
| ii.H+ |
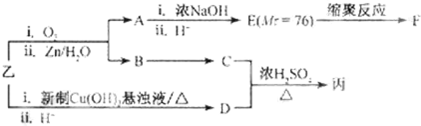
查看答案和解析>>
科目:高中化学 来源: 题型:
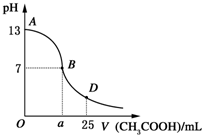 I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com