
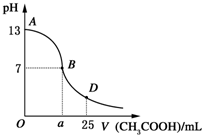
 I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
| 0.02mol |
| 0.2L |
| 1×10-13 |
| 0.1 |


科目:高中化学 来源: 题型:
| A、单质的熔、沸点逐渐降低 |
| B、卤素离子的还原性逐渐增强 |
| C、单质的氧化性逐渐增强 |
| D、气态氢化物的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇、乙烯和植物油都能使酸性高锰酸钾褪色 |
| B、乙醇、乙烷、乙酸都可以与钠反应生成氢气 |
C、聚丙烯的结构简式为: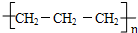 |
| D、用灼烧闻气味的方法可以区分纯棉织物和纯毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
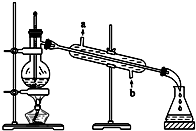 甘油的分离
甘油的分离查看答案和解析>>
科目:高中化学 来源: 题型:
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若混合后溶液pH=7,则c(NH4+)═c(Cl-) |
| B、若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、若a=2b,则(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、若混合后溶液满足c(H+)═c(OH-)+c(NH3?H2O),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 加入n(NaCl)/mol | 测得溶液中n(Cu2+)/mol | 测得溶液中n(Cl-)/mol |
| 1 | 3 | 0 | 1 |
| 2 | 2.4 | 0 | 0.4 |
| 3 | 2 | 0 | 0 |
| 4 | 1.2 | 0 | 0 |
| 5 | 1 | 0 | 0 |
| 6 | 0.4 | 0.2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体 | 硫酸具有还原性 |
| C | AgI沉淀中滴入稀KCl溶液,有白色沉淀出现 | AgCl比AgI更难溶 |
| D | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com