
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、绿色化学的核心是利用化学原理治理环境污染 |
| C、将煤气化或液化,获得清洁燃料 |
| D、PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁柱上铆上一些锌片 |
| B、制造铁柱时,向铁中渗入一定比例的铜制成合金 |
| C、在铁柱表面涂上一层较厚的沥青 |
| D、在铁柱表面镀锡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
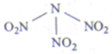 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
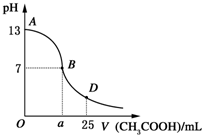 I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:
I.如图所示,向25mL 0.1mol?L-1 NaOH溶液中逐滴滴加0.2mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线.请回答:| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20 mol/(L?s) |
| B、40 mol/(L?s) |
| C、60 mol/(L?s) |
| D、15 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若生成1 mol Fe,则吸收的热量小于akJ |
| B、若要提高CO的转化率,则应该加入适当的过量Fe0 |
| C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com