
| A、20 mol/(L?s) |
| B、40 mol/(L?s) |
| C、60 mol/(L?s) |
| D、15 mol/(L?s) |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、K2O、MgO、CaO |
| B、MgO、K2O、CaO |
| C、MgO、CaO、K2O |
| D、CaO、MgO、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
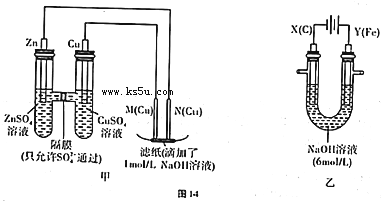
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
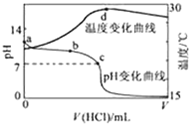 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 加入n(NaCl)/mol | 测得溶液中n(Cu2+)/mol | 测得溶液中n(Cl-)/mol |
| 1 | 3 | 0 | 1 |
| 2 | 2.4 | 0 | 0.4 |
| 3 | 2 | 0 | 0 |
| 4 | 1.2 | 0 | 0 |
| 5 | 1 | 0 | 0 |
| 6 | 0.4 | 0.2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- |
| B、能使淀粉碘化钾试纸显蓝色的溶液:NH4+、Cu2+、S2-、SO42- |
| C、0.1mol.L-1碱溶液:Al3+、Fe3+、SO42-、Cl2 |
| D、由水电离的c(H+)=10-12mol?L-1的溶液:K+、Na+、SiO32-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com