
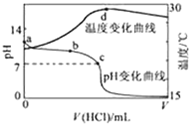
 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |


科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、0.1 mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| D、0.1 mol?L-1的醋酸钠溶液20 mL与0.1 mol?L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| B、新制备的氯水中只存在三种分子、三种离子 |
| C、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、浓硝酸与浓盐酸一样,在空气中出现白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
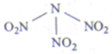 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3OH).c(H2O) |
| c3(H2).c(CO2) |
| A、该反应的化学方程式为3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H>O |
| B、在恒温、恒容的密闭容器中,混合气体的密度不再改变时,该反应一定达到平衡状态 |
| C、在恒温、恒容的密闭容器中,增大H2的浓度时,CO2的转化率增大 |
| D、平衡时,其他条件不变,使用催化剂有利用于CO2的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20 mol/(L?s) |
| B、40 mol/(L?s) |
| C、60 mol/(L?s) |
| D、15 mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
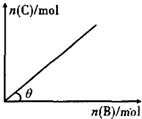 一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )
一定条件下,恒容的密闭容器中,加人一定量的A与B发生反应A(s)+2B(g)?C(g)+2D(g)△H<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示.下列说法正确的是( )| A、增加A的物质的量,正反应速率加快 |
| B、平衡时,其他条件不变,当温度升高时,θ变大 |
| C、图中曲线的斜率表示反应的化学平衡常数 |
| D、平衡时,其他条件不变,再通入B,则反应混合物的温度升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C、杂化轨道理论与价层电子互斥理论都可以分析分子的空间构型 |
| D、[Cu(NH3)4]2+和CH4两个微粒中中心原子Cu和C都是通过sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 取某溶液少许,依次加入BaCl2和稀盐酸 | 确定该溶液中含有SO42- |
| B | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠中含有醛基 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中滴加稀盐酸有气泡产生. | 确定常温下BaCO3的溶解度比BaSO4小 |
| D | 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的溴离子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com