
无机化合物A中含有金属Li元素,遇水强烈水解,主要用于有机合成和药物制造,是具有良好前景的储氢材料。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。
回答下列问题:
(1)A的化学式是 , C的电子式是 。
(2)写出化合物A与盐酸反应的化学方程式: 。
(3)某同学通过查阅资料得知物质A的性质:
Ⅰ.工业上可用金属D与液态的C在硝酸铁催化下反应来制备A物质,纯净的A物质为白色固体,但制得的粗品往往是灰色的。
Ⅱ.物质A熔点390℃,沸点430℃,密度大于苯或甲苯,不溶于煤油,遇水反应剧烈,也要避免接触酸和酒精。在空气中化合物A缓慢分解,对其加强热则猛烈分解,但不会爆炸.在750~800℃分解为化合物E和气体C。
①物质A在750~800℃分解的方程式为: 。
②久置的物质A可能大部分变质而不能使用,需将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理 。
(4)工业制备单质D的流程图如下:
①步骤①中操作名称: 。
②试用平衡原理解释步骤②中减压的目的: 。
(1)LiNH2 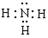
(2)LiNH2 +2HCl ="LiCl" + NH4Cl
(3)①3LiNH2 Li3N + 2NH3↑
Li3N + 2NH3↑
② LiNH2密度大于苯或甲苯且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇可以跟LiNH2反应,方程式为:LiNH2+C2H5OH C2H5 OLi + NH3可将其销毁。
C2H5 OLi + NH3可将其销毁。
(4)①蒸发浓缩、冷却结晶
② LiCl﹒H2O(S) LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g) 减小压强,有利于上述平衡向正方向移动,有利于无水LiCl的制备。
解析试题分析:(1)由题给的信息:“已知无机化合物A中含有Li元素,遇水强烈水解”,“在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C (标准状况)。已知气体C极易溶于水得到碱性溶液, 电解无水B可生成金属单质D和氯气。”可推知C为NH3,并依据电解熔融的金属氯化物可以得到金属单质和氯气的知识,可推知B为LiCl。则固体A与NH4Cl固体反应可表为:A+ NH4Cl — LiCl + NH3,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,反应生成的LiCl也应为0.1mol,那么化合物A中含Li元素也为0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),就可推出该反应的化学方程式为应:LiNH2 + NH4Cl =" LiCl" + NH3,由此可知A是LiNH2,LiNH2的摩尔质量为23.0g/mol,2.30g LiNH2为0.1mol,符合化学反应方程式中的化学计量数, NH3分子的电子式为: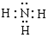
(2)根据化合物A(LiNH2)遇水强烈水解,能生成LiOH和NH3,所以其与盐酸反应的应为:LiNH2 +2HCl ="LiCl" + NH4Cl。
(3)①根据质量守恒(原子守恒),即可推出LiNH2在750~800℃分解的方程式为:3LiNH2 Li3N + 2NH3↑。
Li3N + 2NH3↑。
②由题给的LiNH2有关性质,用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇销毁变质的LiNH2的化学原理是“LiNH2密度大于苯或甲苯,且不溶于它们,所以可用苯或甲苯进行覆盖;乙醇可以跟LiNH2反应:LiNH2+C2H5OH C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。
C2H5OLi + NH3,可将其销毁。”这里必须注意,应回答的是解释其化学原理,而不是解释其原因。
(4)通过工业制备单质Li的流程图可知:①步骤①是要从LiCl溶液获得LiCl﹒H2O晶体,所以,其操作应为:蒸发浓缩、冷却结晶、过滤、洗涤。步骤①中的操作己经有过滤、洗涤,还应有“蒸发浓缩、冷却结晶”。
②步骤②是要将LiCl﹒H2O晶体在减压、干燥的氯化氢气氛中加热(200℃)生成无水LiCl,然后经步骤③电解熔融的LiCl制得金属Li。因此根据LiCl﹒H2O晶体脱去结晶水生成无水LiCl的反应:LiCl﹒H2O(S) LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S)
LiCl (s) + H2O(g),是一个扩大气体体积的反应,所以减小压强,有利于平衡LiCl﹒H2O(S) LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。
LiCl (s) + H2O(g)向正方向移动,有利于无水LiCl的制备。
考点:化学工艺流程,元素及其化合物性质


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:填空题
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g样品与2.0 mol·L-1 NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示。请回答下列问题: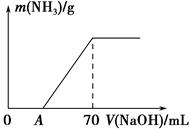
(1)A点前样品与NaOH反应的离子方程式为 。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 (填字母序号)。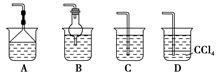
(3)样品中(NH4)2CO3的质量分数是 %(保留一位小数)。
(4)当V(NaOH)=50 mL时,生成NH3的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是________。
(2)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(3)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
(4)现有m g某气体,它的摩尔质量为M g·mol-1,则
①该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为________。
②该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若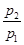 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是200 mg MnC2O4·2H2O晶体放在坩埚里加热分解时,所得固体产物的质量(m)随温度(T)变化的曲线(已知草酸锰不稳定,但其中锰元素的化合价在300 ℃以下不变)。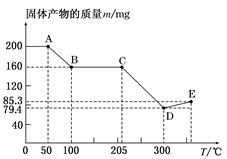
试回答下列问题:
(1)写出B点固体产物的化学式:_________________________________________。
(2)从B点到C点过程中固体物质质量不变的原因是_____________________________________________________。
(3)通过计算确定D点产物的相对分子质量,并推断其合理的化学式:____________
(4)从D点到E点过程中固体物质质量增加的原因是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和)。
(1)溶液中H+的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时,溶液中的Fe2+物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取20 mL NaOH溶液平均分成两份,分别放入A、B两支试管中。向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下表所示:
| 盐酸体积(单位:mL) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮做氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,则推进剂中联氨的质量________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O 6NO2+ 8NH3=7N2+12H2O。NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。则①该混合气体中NO与NO2的体积比为________,②吸收后氨水的物质的量浓度________(答案保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com