
【题目】100mL浓度为2mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol·L-1的盐酸 B.加入少量醋酸钠溶液
C.加热 D.加入少量金属钠
科目:高中化学 来源: 题型:
【题目】白藜芦醇(C14H12O3)是一种天然的肿瘤化学预防剂,来源于花生、葡萄和桑葚等植物。该物质属于
A. 无机物 B. 有机物 C. 单质 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.0~60s,以X的浓度变化表示的反应速率为0.001mol·L-1·s-1
B.将容器体积变为20L,Z的平衡浓度变为原来的![]()
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg![]() 。下列叙述中正确的是( )
。下列叙述中正确的是( )
①任何温度下,纯水的AG等于0
②溶液的AG越小,酸性越强
③25 ℃时,0.1 mol·L-1盐酸的AG=12
④25 ℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④
C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
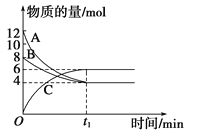
(1)反应的化学方程式为_______________。
(2)从开始到t1 min末时,用物质C表示的反应速率为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于组成细胞的元素、化合物的叙述,正确的是
A. 组成细胞的最基本元素有C、H、O、N
B. 细胞中含量最多的有机物是蛋白质
C. 微量元素不但含量少,而且作用也小
D. 不同细胞中含有的化学元素种类差距很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施是为了降低化学反应速率的是( )
A. 食品放在冰箱中贮藏
B. 双氧水制氧气时加入少量二氧化锰
C. 试管中进行镁和水反应时,稍微加热
D. 铁粉代替铁钉与稀硫酸反应制取氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列各项叙述正确的是
①常温下,0.1molCl2分别与足量NaOH溶液和水反应,转移的电子数目均为0.1NA
②1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
③标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA
④1L 2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA
⑤1 L 2 mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2 NA
⑥6.0 g SiO2晶体中含有的硅氧键数目为0.4 NA
⑦1 molCH5+所含的电子数为10NA
⑧在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
⑨300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
⑩标准状况下,2.24 L乙醇分子所含的C-H键数为 0.5NA
A.②③⑦⑧⑨⑩ B.①②③⑤⑧⑨ C.②⑤⑥⑦⑧ D.①②③⑦⑧⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备ClO2,反应如下:
NaClO2+HCl→ClO2↑+NaCl+H2O(没有配平)
(1)配平方程式。
![]() NaClO2+
NaClO2+![]() HCl—
HCl—![]() ClO2↑+
ClO2↑+![]() NaCl+
NaCl+![]() H2O
H2O
(2)该反应中氧化剂和还原剂的物质的量之比_______________________。生成0.2 mol ClO2转移电子的物质的量为________mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com