
【题目】下列实验装置中所用仪器、试剂、现象和结论均正确的是
选项 | 装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀生成 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有乙烯 |
C |
| 分液漏斗液体流下,锥形瓶中产生大量气体 | 快速制备和收集一定量的氨气 |
D |
| 试管中依次出现白色,黄色沉淀 | 说明 Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】Ⅰ.合成氨工业中,每生产![]() ,放出
,放出![]() 热量。
热量。
(1)写出合成氨反应的热化学方程式___________。
(2)已知:

![]() 键断裂吸收的能量等于_______
键断裂吸收的能量等于_______![]() (计算结果取整数)。
(计算结果取整数)。
Ⅱ.人工肾脏可用间接电化学方法除去代谢产物中的尿素[化学式为![]() ],原理如图。
],原理如图。
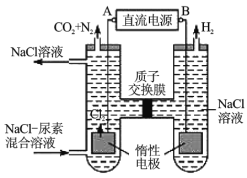
(1)电源的负极为__________(填“A”或“B”)。
(2)阳极室中发生的反应依次为_________,_________。
(3)电解结束后,阴极室溶液的![]() 与电解前相比将__________(填“增大”、“减小”或“不变”)。
与电解前相比将__________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性联氨燃料电池具有能量密度较高和无污染等特点,其工作原理如下图所示,下列说法不正确的是

A.负极反应:N2H4-4e-=4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液碱性不变(不考虑电解质溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=___________。
2CO2(g)+N2(g) △H=___________。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化如图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=2MPa,则T℃时该反应的压力平衡常数Kp=___________;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.15 mol,平衡将___________ (填“向左”、“向右”或“不”)移动。
②15min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是___________(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
II.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(3)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为___________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.11g基态硼原子含有的未成对电子数为3NA
B.1mol基态氟原子能量最高的能级上电子数为7NA
C.100mL1molL-l亚硫酸钠溶液含有的阴离子数目大于0.1NA
D.电解法精炼铜,阴极析出64gCu时,阳极转移的电子数大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法利用 CO2制备甲酸盐可实现 CO2资源化利用, 其装置如图所示:

下列说法错误的是
A.a 极为正极,K+由左向右通过交换膜
B.乙池中的反应为 CO2+HCO3-+2e-= HCOO-+ CO32-
C.电解过程中,Pt 电极产生的气体可以用作燃料电池的负极反应
D.两池的溶液 KHCO3浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是极具发展潜力的清洁能源,氢气的开发和综合利用是目前全球重要的科研项目之一。回答下列问题:
(1)T℃时,向体积均为1L的甲、乙两个恒容容器中分别加入足量碳和0.1molH2O(g),发生反应:H2O(g)+C(s)CO(g)+H2(g) △H>0。甲容器控制绝热条件,乙容器控制恒温条件,两容器中压强随时间的变化如图所示。
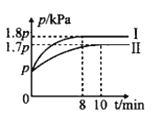
①图中代表甲容器的曲线为__(填“Ⅰ”或“Ⅱ”)。
②下列关于甲容器反应体系的说法错误的是__。
A.当水蒸气的体积分数不再发生变化,反应达到平衡状态
B.从密闭容器中分离出部分固体碳,H2的体积分数减小
C.缩小容器体积,平衡逆向移动,平衡常数减小
D.向平衡体系中充入少量水蒸气,再次平衡后,容器中c(CO)增大
③乙容器中,从反应开始到达平衡,v(H2O)=__molL-lmin-l;T℃下,该反应的平衡常数Kp=___(用含p的代数式表示)。
(2)对于反应aA(g)+bB(g)cC(g)+dD(g),速率方程v═kcm(A)cn(B),k为速率常数(只受温度影响),m+n为反应级数。已知H2(g)+CO2(g)CO(g)+H2O(g),CO的瞬时生成速率=kcm(H2)c(CO2)2。一定温度下,控制CO2起始浓度为0.25molL-1,改变H2起始浓度,进行以上反应的实验,得到CO的起始生成速率和H2起始浓度呈如图所示的直线关系。
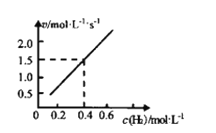
①该反应的反应级数为__。
②速率常数k=__。
③当H2的起始浓度为0.2molL-1,反应进行到某一时刻时,测得CO2的浓度为0.2molL-1,此时CO的生成瞬时速率v=__molL-ls-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙稀(![]() )是重要的有机化工原料。工业上以乙苯(
)是重要的有机化工原料。工业上以乙苯(![]() )为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:
)为原料,采用催化脱氢的方法制取苯乙稀的化学方程式为:![]() △H=124kJ·mol-1
△H=124kJ·mol-1
(1)25℃、101 kPa 时,1 mol 可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。 已知:H2 和苯乙烯的燃烧热 △H 分别为-290 kJ·mol -1 和-4400 kJ·mol-1,则乙苯的燃烧热△H=_____kJ·mol-1。
(2)在体积不变的恒温密闭容器中,发生乙苯催化脱氢的反应,反应过程中各物质浓度随时间变化的关系如图所示。 在 t1 时刻加入 H2,t2 时刻再次达到平衡。
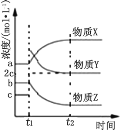
①物质 X 为_____,判断理由是_____;
②乙苯催化脱氢反应的化学平衡常数为_____(用含 a、b、c 的式子表示)。
(3)在体积为 2 L 的恒温密闭容器中通入 2 mol 乙苯蒸气,2 min 后达到平衡,测得氢气的浓度是 0.5 mol·L-1,则乙苯蒸气的反应速率为_____;维持温度和容器体积不变,向上述平衡中再通入 1.5 mol 氢气和 1.5 mol 乙苯蒸气,则 v 正______v 逆(填“大于”、“小于”或“等于”)。
(4)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比(M)对乙苯的平衡转化率的影响如图所示。[M=![]() ]
]
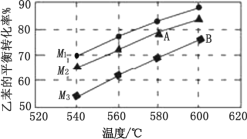
①比较图中 A、B 两点对应的平衡常数大小:KA_____KB(填“>”、“<”或“=”);
②图中投料比 M1、M2、M3 的大小顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法正确的是( )
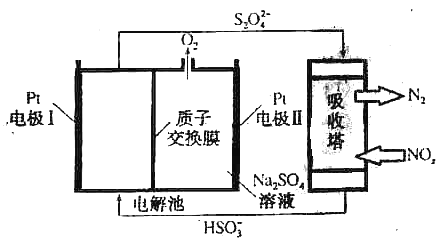
A.电解过程中,Pt电极I上发生氧化反应
B.电解过程中,Pt电极II上发生反应:4OH--4e-=2H2O+O2↑
C.电解过程中,左极室pH会逐渐减小,
D.若NOx为NO,转移1mol电子时吸收塔中消耗0.5molS2O42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com