
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
 =0.025��
=0.025�� =0.02��K��Qc��˵��ƽ��������Ӧ�����ƶ�����Ӧ��ƽ��ǰv��������v���棩����C��ȷ��D����ЧΪ��ʼ����2.0molPCl5����ԭƽ����ȣ�ѹǿ����ƽ�����淴Ӧ�����ƶ���ƽ��ʱ��PCl5ת���ʽ�ԭƽ��ͣ���ƽ��ʱPCl3�����ʵ���С��1.6mol������ͬ�¶��£���ʼʱ�������г���2 mol PCl3����2.0 mol Cl2���ﵽƽ��ʱ��PCl3�����ʵ���С��1.6mol���μӷ�Ӧ��PCl3�����ʵ�������1.6mol���ʴﵽƽ��ʱ��PCl3��ת���ʸ���80%����D����ѡC��
=0.02��K��Qc��˵��ƽ��������Ӧ�����ƶ�����Ӧ��ƽ��ǰv��������v���棩����C��ȷ��D����ЧΪ��ʼ����2.0molPCl5����ԭƽ����ȣ�ѹǿ����ƽ�����淴Ӧ�����ƶ���ƽ��ʱ��PCl5ת���ʽ�ԭƽ��ͣ���ƽ��ʱPCl3�����ʵ���С��1.6mol������ͬ�¶��£���ʼʱ�������г���2 mol PCl3����2.0 mol Cl2���ﵽƽ��ʱ��PCl3�����ʵ���С��1.6mol���μӷ�Ӧ��PCl3�����ʵ�������1.6mol���ʴﵽƽ��ʱ��PCl3��ת���ʸ���80%����D����ѡC��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CO(g)��3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
 CH3OH(g)������
CH3OH(g)������| ʵ���� | T(��C) | n(CO)/n(H2) | p(MPa) |
| �� | 150 | ½ | 0.1 |
| �� | ________ | ________ | 5 |
| �� | 350 | ________ | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����(˫ѡ) (����)��
2SO3(g)���Ʊ��������Ҫ��Ӧ������������ȷ����(˫ѡ) (����)��| A������V2O5�ɸı�÷�Ӧ�������淴Ӧ���� |
| B������Ӧ��ϵ��ѹǿ����Ӧ����һ������ |
| C���÷�Ӧ�Ƿ��ȷ�Ӧ�������¶Ƚ����̷�Ӧ�ﵽƽ���ʱ�� |
D����t1��t2ʱ�̣�SO3(g)��Ũ�ȷֱ���c1��c2����ʱ����t1��t2�ڣ�SO3(g)���ɵ�ƽ������Ϊv�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Y(g) + Z(g) ��H<0����Ӧһ��ʱ���ı�ijһ�������������Ӧ�и�ʱ��X���ʵ�Ũ�����±���ʾ������˵���в���ȷ����
Y(g) + Z(g) ��H<0����Ӧһ��ʱ���ı�ijһ�������������Ӧ�и�ʱ��X���ʵ�Ũ�����±���ʾ������˵���в���ȷ����| ��Ӧʱ�䣨min�� | 0 | 5 | 15 | 17 | 20 |
| X��Ũ�ȣ�mol��L��1�� | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����H<0��ij�о�С���о�������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ� ��
2SO3(g)����H<0��ij�о�С���о�������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ� �� 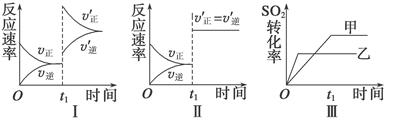
| A��ͼ���ʾ����t1ʱ������ѹǿ�Է�Ӧ���ʵ�Ӱ�� |
| B��ͼ���ʾ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ�� |
| C��ͼ���ʾ���Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ� |
| D��ͼ���ʾ����ѹǿ�Ի�ѧƽ���Ӱ�죬���ҵ�ѹǿ�ϸ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)����H<0���ڲ�ͬ�¶ȡ���ͬѹǿ��p1��p2���£��ﵽƽ��ʱ�����������Z�İٷֺ������¶ȱ仯������ӦΪ
2Z(g)����H<0���ڲ�ͬ�¶ȡ���ͬѹǿ��p1��p2���£��ﵽƽ��ʱ�����������Z�İٷֺ������¶ȱ仯������ӦΪ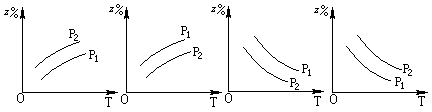
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 4NO(g)+6H2O (g) ��H=" -1025" KJ/mol
4NO(g)+6H2O (g) ��H=" -1025" KJ/mol 
| ʱ�䣯Ũ�� | c(NH3)(mol/L) | C(O2)(mol/L) | C(NO)(mol/L) |
| ��ʼ | 0.8 | 1.5 | 0 |
| ��2min | 0.7 | a | 0.1 |
| ��4min | 0.4 | 1.0 | 0.4 |
| ��6min | 0.4 | 1.0 | 0.4 |
| ��8min | 1.2 | 2.5 | 0.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
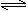 2NH3(g) ��H��0�������о�Ŀ�ĺ�ʾ��ͼ�������( )
2NH3(g) ��H��0�������о�Ŀ�ĺ�ʾ��ͼ�������( )| | A | B | C | D |
| �о� Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�� (p2>p1) | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�� Ũ�ȶԷ�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼ | 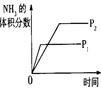 |  | 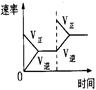 | 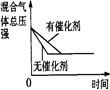 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com