
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。| A.催化剂V2O5可改变该反应的正、逆反应速率 |
| B.增大反应体系的压强、反应速率一定增大 |
| C.该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
D.在t1,t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v= |
科目:高中化学 来源:不详 题型:单选题
| A.溴水中存在Br2+H2O?HBr+HBrO,加入AgNO3溶液,溴水渐渐褪色 |
| B.对处于平衡态2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 |
| C.醋酸稀溶液加热后溶液pH降低(不考虑醋酸受热挥发) |
| D.合成氨时适当增大压强有利于提高氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) ΔH<0。如图是容器中X、Z的物质的量浓度随时间变化的曲线。
| A.用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol·L-1·min-1 |
| B.根据上图可求得化学方程式中a∶b=1∶3 |
| C.推测在第7 min时曲线变化的原因可能是升温 |
| D.推测在第13 min时曲线变化的原因可能是降温 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,在一个有催化剂的固定容积的容器中加入2mol
,在一个有催化剂的固定容积的容器中加入2mol 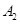 和1mol
和1mol 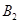 ,在500℃时充分反应达平衡后
,在500℃时充分反应达平衡后 的浓度为w mol/L,放出热量b kJ。
的浓度为w mol/L,放出热量b kJ。 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
 时充分反应达平衡后,吸收热量ckJ,
时充分反应达平衡后,吸收热量ckJ, 的浓度________(填>、=、<)w mol/L。
的浓度________(填>、=、<)w mol/L。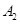 和2mol
和2mol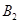 B.4mol
B.4mol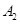 、2mol
、2mol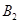 和2mol
和2mol 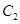
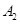 和4mol
和4mol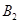 D.6mol
D.6mol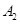 和4mol
和4mol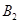
 气体 B.适当升高温度
气体 B.适当升高温度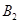 的浓度 D.选择高效的催化剂
的浓度 D.选择高效的催化剂查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2; 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是( )
N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是( )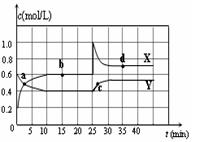
| A.图中的两条曲线,X表示NO2浓度随时间的变化曲线 |
| B.前10 min内用v(N2O4 ) =" 0.2" mol/(L·min) |
| C.25 min时,NO2转变为N2O4的反应速率增大,其原因是将密闭容器的体积缩小为1L |
| D.前10 min内用v(NO2) =" 0.04" mol/(L·min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com