
����Ŀ����1���ڢ�![]() ��ʯī��C60��
��ʯī��C60��![]() ��CH3CH2OH��
��CH3CH2OH��![]() ��
��![]() ��CH3OCH3�У���Ϊͬλ�أ�______��Ϊͬ���칹��_______����Ϊͬ��������_______������ţ���
��CH3OCH3�У���Ϊͬλ�أ�______��Ϊͬ���칹��_______����Ϊͬ��������_______������ţ���
��2�����Т�CaCl2 �ڽ��ʯ ��NH4Cl ��Na2SO4 �ݱ����������ʣ�������Ҫ��ش�
I.�ۻ�ʱ����Ҫ�ƻ���ѧ������_______���۵���ߵ���_________��������ţ�
II.ֻ�������Ӽ���������_________�������Է��Ӽ���������ϵ���_________��������ţ�
��3��д���������ʵĵ���ʽ
��H2O______��NaOH______��NH3______��
��4��д��CO2�Ľṹʽ______��д����ԭ�ӵ�ԭ�ӽṹʾ��ͼ______��
���𰸡��٢� �ݢ� �ڢ� �� �� �� �� ![]()
![]()
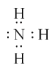 O=C=O
O=C=O 
��������
��1����ͬλ�أ���������ͬ����������ͬ��ͬһԪ�صIJ�ͬԭ�ӣ�ͬ���칹�壺����ʽ��ͬ���ṹ��ͬ�����ʣ�ͬ�������壺ͬ��Ԫ���γɵIJ�ͬ���ʣ����ݸ�����������
��2����ȷ���������ͣ���ȷ����ѧ����
��3����ȷ����ѧ�����ͣ���ȷ������ʽ��
��4����ȷ����ѧ�����ͣ���ȷ���ṹʽ����ԭ��Ϊ16��Ԫ�أ�д��ԭ�ӽṹʾ��ͼ��
��1������ͬλ�أ���������ͬ����������ͬ��ͬһԪ�صIJ�ͬԭ�ӣ�ͬ���칹�壺����ʽ��ͬ���ṹ��ͬ�����ʣ�ͬ�������壺ͬ��Ԫ���γɵIJ�ͬ���ʡ���ˢ٢�Ϊͬλ�أ��ݢΪͬ���칹�壻�ڢۻ�Ϊͬ�������壻
�𰸣��٢� �ݢ� �ڢ�
��2����CaCl2Ϊ���Ӿ��壬�������Ӽ����ڽ��ʯΪԭ�Ӿ��壬���ڹ��ۼ��� ��NH4Cl ���Ӿ��壬�������Ӽ����ۼ�����Na2SO4Ϊ���Ӿ��壬�������Ӽ����ۼ��� �ݱ�Ϊ���Ӿ��壬���ڹ��ۼ���
I.�ۻ�ʱ���Ӿ����ƻ����Ӽ���ԭ�Ӿ����ƻ����ۼ������Ӿ����ƻ����Ӽ���������ͨ��������۵�ԭ�Ӿ���>���Ӿ���>���Ӿ��壻
II.ֻ�������Ӽ����������Ȼ��ƣ����Ӿ����Է��Ӽ���������ϣ�
�𰸣��� �� �� ��
��3����H2OΪ���ۻ��������O-H���ۼ���NaOH�������Ӻ����������Ӵ������Ӽ��������������ڲ�����O-H���ۼ��۰���Ϊ���ۻ��������N-H���ۼ���
�����ʽΪ![]() ��
�� ![]() ��
�� 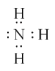 ��
��
�𰸣�![]()
![]()
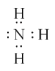
��4��CO2Ϊ���ۻ��������8�����ȶ��ṹ��ȷ���ṹʽΪO=C=O����ԭ��Ϊ16��Ԫ�أ�ԭ�ӽṹʾ��ͼ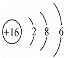 ��
��
�𰸣�O=C=O 


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�г�������ͼ����һ�����ֶ���������ͻ��ʵ��װ�õ�Ҫ�㣬����ز�����ѧ���̵�ԭ���� �����йػ�ѧͼ����ֵ�������ȷ����
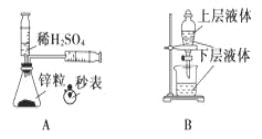
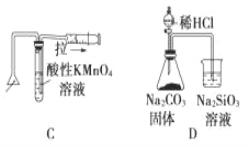
A. �ⶨһ��ʱ�������� H2 �ķ�Ӧ���� B. ��ȡ�����еĵ�
C. ������ȼ�ղ����� SO2 D. ֤���ǽ����ԣ�Cl>C>Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.��ҵ�ý�̿�ڸ����»�ԭ���������Ƶøߴ���
B.SiO2������������ά
C.����һ��ǿ��ԭ���������ѡ�ﯡ���ȴ������������û�����
D.����þ�۵�ߴ�250���������ʵ����²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Cl2��˵���У�����ȷ����
A. Cl2��һ�ֻ���ɫ���ж����� B. �����Cl2�ɱ����ڸ�ƿ��
C. ��˿��Cl2��ȼ������FeCl3 D. ������Һ�������ֲ�ͬ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʱ������˵����ȷ����
A. ʹ�ô���һ���ܼӿ췴Ӧ����
B. �÷�ĩ״п�����״п��ϡ���ᷴӦһ����ӿ췴Ӧ����
C. ��N2��3H2![]() 2NH3��Ӧ�У�����N2Ũ��һ������ʹH2ȫ��ת��ΪNH3
2NH3��Ӧ�У�����N2Ũ��һ������ʹH2ȫ��ת��ΪNH3
D. ����Ӧ����������Ũ�����ʱ�����淴Ӧһ�����ﵽ��ѧ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е�����ָ����Һ��һ���ܴ����������(����)
A. c(FeCl3)��1.0 mol��L��1����Һ�У�HCO![]() ��Cl����H����Na��
��Cl����H����Na��
B. �����£���ˮ�������c(H��)��10��14mol��L��1��Һ�У�NH![]() ��K����CO
��K����CO![]() ��SO
��SO![]()
C. ��c(HCO![]() )��0.1 mol��L��1����Һ�У�NH
)��0.1 mol��L��1����Һ�У�NH![]() ��AlO
��AlO![]() ��Cl����NO
��Cl����NO![]()
D. �����£� 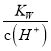 ��0.1 mol��L��1����Һ�У�K����NH3��H2O��SO
��0.1 mol��L��1����Һ�У�K����NH3��H2O��SO![]() ��NO
��NO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˹�������ü�ӵ绯ѧ������ȥ��л�����е�����CO(NH2)2��ԭ����ͼ�������й�˵����ȷ����(����)
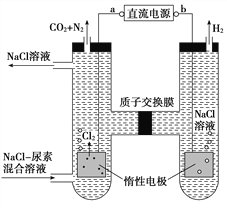
A. aΪ��Դ�ĸ���
B. ����������������Һ��pH����ǰ��Ƚ�����
C. �������з����ĵ缫��ӦΪ2H����2e��=H2��
D. ���������ռ��������Ʒ13.44 L(��״��)�����ȥ������Ϊ7.2 g(����������ܽ�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 298 Kʱ��2H2S(g)��SO2(g)===3S(s)��2H2O(l) ���Է����У�������H<0
B. ͭ�Ļ�ѧ���ʱ����ȶ�������բ�ϰ�װͭ��ɼ�����բ�ĸ�ʴ����
C. Ǧ���طŵ�ʱ�ĸ����ͳ��ʱ������������������Ӧ
D. �����£�pH��Ϊ5���������Ȼ����Һ�У�ˮ�ĵ���̶���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ,��2 L�ܱ������ڣ�400 ��ʱ������ӦCO(g)+2H2(g) ![]() CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����
CH3OH(g)����ϵ��n(CO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

��1��ͼ�б�ʾCH3OH �ı仯��������_______��
��2�����д�ʩ������߷�Ӧ���ʵ���_________(������Ӧ��ĸ���)��
a.�����¶� b.������� c.����ѹǿ d.��ʱ�����CH3OH
��3������������˵����Ӧ�ﵽƽ��״̬����__________(������Ӧ��ĸ���)��
a.CO��H2��Ũ�ȱ��ֲ��� b.v(H2)=2 v(CO)
c.CO�����ʵ����������ֲ��� d.�����������ܶȱ��ֲ���
e.ÿ����1molCH3OH��ͬʱ��2molH-H������
��4��CH3OH��O2�ķ�Ӧ�ɽ���ѧ��ת��Ϊ���ܣ��乤��ԭ����ͼ��ʾ��ͼ��CH3OH��__________����A��B��ͨ�룬b���ĵ缫��Ӧʽ��__________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com