
【题目】下列说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l) 能自发进行,则其ΔH<0
B. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
C. 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类或变化正确的是( )
①混合物:氯水、氨水、水玻璃、水银、食醋、淀粉 ②含有氧元素的化合物叫氧化物 ③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2 为碱性氧化物 ④同素异形体:C60、C70、金刚石、石墨 ⑤在熔融状态下能导电的化合物为离子化合物 ⑥强电解质溶液的导电能力一定强 ⑦有单质参加的反应或有单质产生的反应是氧化还原反应 ⑧煤的气化、液化、干馏都是化学变化
A. ④⑤⑧ B. ②③⑤ C. ①④⑥⑦ D. ③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①![]() ②石墨③C60④
②石墨③C60④![]() ⑤CH3CH2OH⑥
⑤CH3CH2OH⑥![]() ⑦
⑦![]() ⑧CH3OCH3中:互为同位素;______互为同分异构体_______;互为同素异形体_______(填序号).
⑧CH3OCH3中:互为同位素;______互为同分异构体_______;互为同素异形体_______(填序号).
(2)现有①CaCl2 ②金刚石 ③NH4Cl ④Na2SO4 ⑤冰等五种物质,按下列要求回答:
I.熔化时不需要破坏化学键的是_______,熔点最高的是_________。(填序号)
II.只含有离子键的物质是_________,晶体以分子间作用力结合的是_________。(填序号)
(3)写出下列物质的电子式
①H2O______②NaOH______③NH3______;
(4)写出CO2的结构式______;写出硫原子的原子结构示意图______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从单质氟到碘,下列情况中不能反映出它们的氧化性强弱不同的是( )
A.单质与卤化物之间的置换情况
B.与氢气反应的情况
C.与硝酸银反应生成卤化银的颜色情况
D.与水反应的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的位置如下图所示,若W原子最外层电子数是其内层电子总数的3/5。下列说法中,正确的是

A. X只有一种氧化物
B. 气态氢化物的稳定性Z>W
C. 原子半径由大到小排列顺序Z>Y>X
D. 元素X是自然界中形成化合物种类最多的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. a点溶液中: c(OH-)+c(CH3COO-)-c(H+) =0.1 mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡( BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiC14+2H2O=TiO2+4HCl
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为_________________,此反应的平衡常数K=__________(填写计算结果)。若不考虑CO32-的水解,则至少需要使用_______mol/L的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)配制TiC14溶液时通常将TiC14固体溶于浓盐酸再加水稀释,其目的是______________。
(3)可循环使用的物质X是____________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:____________________。
(4)写出煅烧草酸氧钛钡晶体的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:__与盐酸反应最剧烈,___与盐酸反应的速度最慢;__与盐酸反应产生的气体最多。
(2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
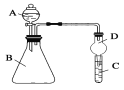
(3)仪器A的名称为________
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_______溶液的洗气瓶除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com