
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
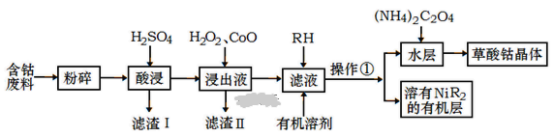
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
【答案】SiO2 增大硫酸的浓度 提高反应的温度、搅拌、将固体粉碎(任选两个) 分液漏斗、烧杯 ![]() 调节pH
调节pH ![]() 取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净 偏高
取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净 偏高
【解析】
用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O):粉碎后用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有CoSO4、NiSO4、FeSO4、Al2(SO4)3及过量的硫酸,滤渣Ⅰ为SiO2,滤液中加入过氧化氢和CoO,将Fe2+氧化为Fe3+,同时调节pH,使铁离子、铝离子转化为沉淀除去,所以滤渣Ⅱ为氢氧化铁、氢氧化铝,向滤液中加入RH,Ni2+溶于有机层,操作①为分液,向水层加入(NH4)2C2O4,得到草酸钴晶体,以此来解答。
(1)用含钴废料,粉碎后用硫酸溶解,SiO2不与硫酸反应,滤渣Ⅰ为SiO2;提高硫酸的浓度、提高反应的温度、搅拌、将固体粉碎均能提高酸浸速率;
(2)通过操作①得到水层和有机层,则操作①为分液,分液需要的仪器有:分液漏斗、烧杯;
(3)H2O2氧化亚铁离子生成铁离子,离子方程式为:![]() ;
;
(4)加入氧化钴的目的是调节溶液的pH,将浸出液中Fe3+和Al3+全部沉淀;
(5)加入(NH4)2C2O4反应的离子方程式为:![]() ,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净;
,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是:取最后一次的洗涤液少许于试管中,滴入盐酸酸化的氯化钡溶液,若无沉淀生成,则证明洗涤干净;
(6)若用盐酸酸化,高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】X溶液中含有下表所示离子中的某5种,且其离子浓度均为![]() (不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 |
|
阴离子 |
|
A.原溶液中一定含有![]()
B.X溶液中不可能含有![]() 和
和![]()
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度为1.5 mol·L-1
B. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
C. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
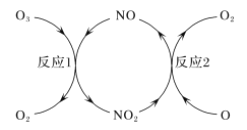
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;

NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
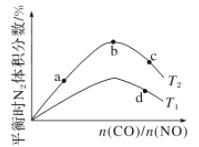
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图。关于该有机物的叙述中正确的是( )
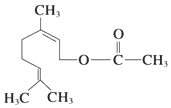
①在Ni催化条件下,1mol该有机物最多可与3mol H2发生加成反应
②该有机物能发生取代、加成、水解、缩聚反应
③该有机物分子式为C12H20O2
④该有机物的同分异构体可能为醇类,不可能为酚类
⑤1mol该有机物水解时只能消耗1mol NaOH
A. ②③④B. ③④⑤C. ②③⑤D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。
(1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应:
①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJmol-1
②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJmol-1
已知Al的燃烧热为 △H3=ckJmol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。
(2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)
请回答下列问题:
①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。
②下列能说明反应已达平衡的有____________________(填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。
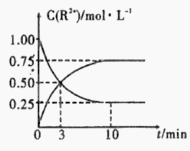
④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。
(3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,能达到实验目的的是( )
|
|
A. 制备 | B. 比较 |
|
|
C. 铝热法制备少量铁单质 | D. 排水法收集氢气 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com