
【题目】X溶液中含有下表所示离子中的某5种,且其离子浓度均为![]() (不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
(不考虑水的电离和离子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 |
|
阴离子 |
|
A.原溶液中一定含有![]()
B.X溶液中不可能含有![]() 和
和![]()
C.X溶液中含有3种阳离子、2种阴离子
D.生成气体的离子反应方程式为![]()
【答案】C
【解析】
各种离子的物质的量浓度均为0.1mol/L,向溶液X中加入足量的盐酸,有气体生成,且反应溶液中阴离子的种类没有变化,产生气体不可能是二氧化碳,则不含OH-、HCO3-和CO32-;根据表中的离子,可推知是Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,生成气体的离子反应方程式为![]() ,NO3-反应后有剩余,故溶液中阴离子种类不变,所以原来溶液中含有Cl﹣。由于总共含有5种离子,根据电荷守恒及离子共存的条件可以判断还含有SO42﹣和Mg2+,所以原溶液中含有的五种离子为:Cl﹣、NO3-、SO42﹣、Fe2+、Mg2+。
,NO3-反应后有剩余,故溶液中阴离子种类不变,所以原来溶液中含有Cl﹣。由于总共含有5种离子,根据电荷守恒及离子共存的条件可以判断还含有SO42﹣和Mg2+,所以原溶液中含有的五种离子为:Cl﹣、NO3-、SO42﹣、Fe2+、Mg2+。
A.根据分析可知,原溶液中一定含有Mg2+,A正确;
B.加入足量盐酸后阴离子种类不变, HCO3-和CO32与-H+反应后就不h存在b了 ,B正确;
C.根据分析可知,原溶液中含有的五种离子为Cl﹣、NO3﹣、SO42﹣、Fe2+、Mg2+,共有2种阳离子、3种阴离子,C错误;
D. Fe2+ 与NO3﹣、H+反应时Fe2+被氧化为三价铁,硝酸根被还原为NO,生成气体的离子反应方程式为![]() ,D正确。
,D正确。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是
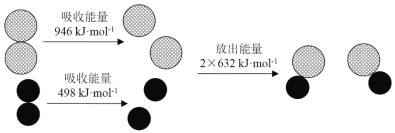
A. 1 mol N2(g)和NA个O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)和O2(g)混合能直接生成NO(g)
D. 吸热反应一定需要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42- 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)判断BaCl2已过量的方法是_______________________________________________。
(2)第④步中,相关的离子方程式是___________________________________________。
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是______________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,其中的错误是____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室做铜与浓硫酸反应的实验。
(1)写出反应的化学方程式_____。
停止加热,将试管中的混合物冷却后倒入装有冷水的烧杯中,搅拌、静置,观察到烧杯底部有黑色物质。于是他对黑色物质进行了探究。
(2)该同学假设黑色物质CuO。检验过程如下:
(查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+)该同学的实验操作:
①将CuO放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色物质放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。实验①的目的是__________,由该检验过程所得结论是________。
(3)再次假设,黑色物质是铜的硫化物。实验如下:
实验装置
| 现象 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现浅红棕色气体 3.B试管中出现…… |
①现象2说明黑色物质具有________性。
② A试管内上方出现浅红棕色气体的化学方程式是__________。
③能确认黑色沉淀中含有S元素的现象_________。
(4)以上实验说明,黑色物质中存在铜的硫化物。进一步实验后证明黑色物质是 CuS与Cu2S的混合物。已知1molCu2S与稀硝酸反应转移8mole-,写出试管A中Cu2S 溶解的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E(C11H12O2) 属于芳香酯类物质,天然物存在于威士忌酒、苹果酒等中,呈水果及玫瑰香气,可由下列路线人工合成:

完成下列填空:
(1)A中官能团的名称是________________;C物质的结构简式是________________。
(2)反应③的条件是_______________;反应④的类型是_____________________。
(3)写出反应⑥的化学方程式:__________________________________________________________________。
(4)如何检验反应②中的A是否完全转化?__________________________________________________________________。
(5)设计一条由![]() 出发,制备
出发,制备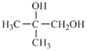 的合成路线(合成路线常用的表示方式为:
的合成路线(合成路线常用的表示方式为: )______________________________。
)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
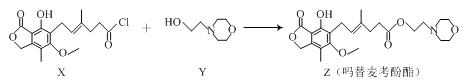 +HCl
+HCl
下列叙述正确的是
A. 用溴水可鉴别化合物X和ZB. 化合物Y的分子式为C6H14NO2
C. 化合物Z中含有手性碳原子D. 1mol化合物Z可以与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
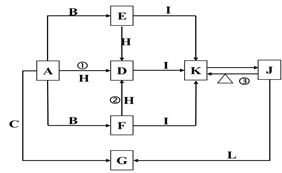
回答下列问题:
(1)A是:____________, I是:____________(填化学式);
(2)按要求写出下列反应的方程式:
Ⅰ.①的化学方程式:______________________________;
Ⅱ.②的化学方程式(同时用双线桥法表示该反应的电子转移情况):________________;
Ⅲ. J与过量的澄清石灰水反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子(小球大小只代表种类不同,与原子半径大小无关),该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层电子数都达到8个电子的稳定结构。下列说法不正确的是 ( )

A. 该化合物的化学式是Al2Cl6
B. 该化合物是离子化合物,在熔融状态下能导电
C. 该化合物在固态时所形成的晶体是分子晶体
D. 该化合物中不存在离子键,也不含有非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O42H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离)
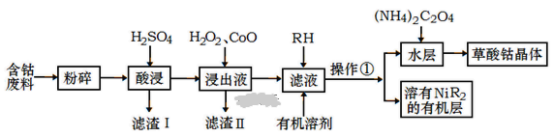
(1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。
(2) 操作①用到的主要仪器有___________________。
(3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。
(4)加入氧化钴的目的是______________________________。
(5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com