
����Ŀ��Ϊ��ȥ�����е�Ca2����Mg2����SO42- �Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽������������(���ڳ������Լ��Թ���)��
![]()
(1)�ж�BaCl2�ѹ����ķ�����_______________________________________________��
(2)�ڢܲ��У���ص����ӷ���ʽ��___________________________________________��
(3)�����������ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ����______________________________��
(4)Ϊ���龫�δ��ȣ�������150 mL 0.2 mol/L NaCl(����)��Һ����ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ�����еĴ�����____________________________________________��

���𰸡� ȡ�ϲ���Һ��������BaCl2���������� Ca2����CO32-��CaCO3����Ba2����CO32-��BaCO3�� ������ǰ��������ǰ�������ɵij����ᱻ������Һ���±�Ϊ���ӽ�����Һ ת��Һ��ʱû���ò���������������ƿ�õ���100 mLӦ����150 mL
��������(1). �������Ȼ����Ὣ��������ӳ�����ȫ�������������ʣ�࣬���Ȼ��������䷴Ӧ���ְ�ɫ�����������ж�BaCl2�ѹ����ķ����ǣ�ȡ�ϲ���Һ����ȡ�����ϲ���Һ���Թ��У����ٵ�������BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ������ʴ�Ϊ��ȡ���ϲ���Һ��������BaCl2��Һ������������
(2). ���ε��ᴿ��������̼���Ƶ������dz�ȥ�������Լ���ǰ�����ı���������Ӧ�����ӷ���ʽΪ��Ca2++CO32=CaCO3����Ba2++CO32=BaCO3�����ʴ�Ϊ��Ca2++CO32=CaCO3����Ba2++CO32=BaCO3����
(3). ���ȼ������ٹ����� ��ǰ�����ɵ�Mg(OH)2��CaCO3��BaCO3�����������ᷴӦ�����������ֽ�����Һ���Ӷ�Ӱ���Ȼ��ƵĴ��ȣ��ʴ�Ϊ��������ǰ�����ᣬǰ�������ɵij����ᱻ������Һ���±�Ϊ���ӽ�����Һ��
(4). ����ͼʾ������ȱ�ٲ���������������ƿ�Ĺ��Ҳ���ԣ�����ƿ�õ���100mLӦ����150mL���ʴ�Ϊ��ת��Һ��ʱû���ò���������������ƿ�õ���100mLӦ����150mL��


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д� �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֡�����Ԫ���ڱ��е�λ�ã����û�ѧ����ش���������:
�� ���� | IA | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
4 | �� | |||||||
5 | �� |
��1�������ۺ�����Ļ�ѧʽΪ_________��
��2���ٺ͢�����Ԫ�ص�ԭ�Ӱ�1:1��ɵij���������ĽṹʽΪ_________��
��3���ۢܢߢ�ļ�����뾶�ɴ�С��˳��Ϊ_________��(�����ӷ��ű�ʾ)
��4���ڢܵ�����������ˮ����֮�䷢����Ӧ�����跽��ʽ_________��
��5���õ���ʽ��ʾ�ۺ͢���ɵĻ�������γɹ���_________��
��6�������к��Т�Ԫ�أ��������к��и�Ԫ�صļ������ӡ��������ữ�£�����˫��ˮ��������Ϊ���ʡ�д���÷�Ӧ�����ӷ���ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��BΪͬ�������Ԫ�أ�A��B����һ���ڣ���A��ԭ������Ϊn����B��ԭ����������Ϊ�� ��
A. n��8 B. n��18 C. n��20 D. n��32
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؾ����ܵ���������ȷ����(����)
A.1mol��̬�������������Ӻ�1mol��̬���������ӽ������1mol���Ӿ���ʱ�ͷų�������Ϊ���Ӿ���ľ�����
B.������ͨ��ȡ��ֵ
C.������Խ���γɵ����Ӿ���Խ�ȶ�
D.������Խ�����ʵ�Ӳ�ȷ���ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Һ�������˵����ȷ���ǣ� ��
A.c(H+)��С����Һһ���ʼ���B.pH = 7����Һһ��������
C.c(H+)=c(OH-)����Һһ��������D.����ʹ��̪��Һ������Һһ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A������������һ����CH2ԭ���ŵ��л�����ͬϵ��
B�������Ԫ������������ͬ������ͬһ����
C������ʽ��ͬ���ṹʽ��ͬ���л���һ����Ϊͬ���칹��
D����Է���������ͬ���л���һ����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ҫ֤��ij��Һ�в���Fe3+�����ܺ���Fe2+��������ʵ�����ʱ���˳��Ϊ�� ��
�ټ���������ˮ �ڼ���������ˮ��Һ �ۼ�������KSCN��Һ
A. �٢� B. �ۢ� C. �ۢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������������������۷�Ӧʱ��Ϊ�˼�����Ӧ���ʵ���Ӱ������H2�����������������м���������
A��CaCO3(s) B��Na2SO4��Һ
C��KNO3��Һ D��CuSO4(s)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
������̫���ܵ���е�����̫���ܵ�ء��ྦྷ��̫���ܵ�ء�GaAs̫���ܵ�ؼ�ͭ��������Ĥ̫���ܵ�صȡ�
��1��Cu+�ڻ�̬ʱ�ļ۵����Ų�ʽΪ______��
��2���顢���ǵ������ڵ�����Ԫ�أ���֪��ĵ�һ�����ܴ����������ԭ�ӽṹ�ĽǶȼ��Խ���______��
��3��GaAs�۵�1238�棬�������ܼ����侧������Ϊ_________��
��4��AsF3�Ŀռ乹���ǣ�______________��
��5�����ᣨH3BO3���������ܵ����H+����ˮ�����һ��OH-����[B(OH)4]-�������������ԡ�
��[B(OH)4]-��Bԭ�ӵ��ӻ�����Ϊ______��
��[B(OH)4]-�ĽṹʽΪ____________��
��6�����ʯ�ľ�������ͼ�����Թ�ԭ�Ӵ�����ʯ�����е�̼ԭ�ӣ���õ�����裺�������ʯ������һ���̼ԭ�ӓQ�ɹ�ԭ�ӣ���̼����ԭ�ӽ��棬���õ�̼���辧�壨���ɰ����
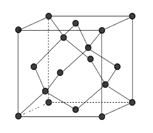
�ٽ��ʯ������衢̼������۵��ɸߵ��͵�����˳����_______(�û�ѧʽ��ʾ)��
��������������Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm��������������ܶ���___________g���M-3(B�����ԭ������Ϊ11��ֻҪ������ʽ�����ؼ������ֵ������٤������ΪNA)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com